2020-2021學年天津市南開中學高三(下)第六次月考化學試卷
發(fā)布:2024/4/20 14:35:0
一、共12題,每題3分,共36分。每小題給出的四個選項中,只有一項是最符合題目要求的。
-
1.化學是現代生產、生活與科技的中心學科之一,下列與化學有關的說法不正確的是( )
A.我國已能利用3D打印技術,以鈦合金粉末為原料,來制造飛機鈦合金結構件。高溫時可用金屬鈉還原相應的氯化物來制取金屬鈦 B.中國政府在聯合國大會上提出:中國將在2060年前實現碳中和。我國科學家利用甲醇低溫所制氫氣用于新能源汽車 C.2022年北京冬奧會上將要使用的聚氨酯速滑服是一種合成高分子材料 D.科研人員積極研發(fā)抗擊新型冠狀病毒的疫苗,疫苗一般冷藏存放以避免蛋白質鹽析 組卷:31引用:1難度:0.7 -
2.下列化學用語對事實的表述不正確的是( )
A.硬脂酸與乙醇的酯化反應:C17H35COOH+C2 OHH185C17H35COOC2H5+濃硫酸△OH182B.常溫時,0.1mol?L-1氨水的pH=11.1:NH3?H2O? +OH-NH+4C.由Na和Cl形成離子鍵的過程: 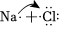 →
→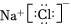
D.電解精煉銅的陰極反應:Cu2++2e-═Cu 組卷:821引用:16難度:0.9 -
3.下列有關物質應用的說法正確的是( )
A.碳酸鈉溶液呈堿性,可用熱的純堿溶液除去金屬表面的煤油 B.為加快漂白精的漂白速率,使用時可滴加幾滴醋酸 C.向飽和硼酸溶液中滴加Na2CO3溶液,有CO2氣體生成 D.鋁表面易形成致密的氧化膜,鋁制器皿可長時間盛放咸菜等腌制食品 組卷:190引用:5難度:0.9 -
4.下列說法正確的是( )
A.50g34%H2O2溶液中含H-O鍵的數目為NA B.用1L1mol?L-1FeCl3溶液充分反應制備氫氧化鐵膠體,該體系中含氫氧化鐵膠體粒子數目為6.02×1023 C.20gH218O和D216O的混合物中含有6.02×1024個中子 D.反應5NaClO2+4HCl═4ClO2↑+5NaCl+2H2O,每轉移2.408×1024個電子時,生成1molClO2 組卷:14引用:1難度:0.5 -
5.我國科研人員提出了由CO2和CH4轉化為高附加值產品CH3COOH的催化反應歷程,該歷程示意圖如圖所示。
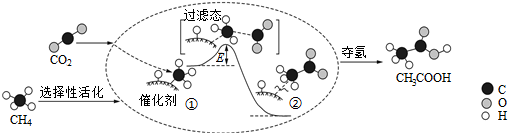
下列說法不正確的是( )A.生成CH3COOH總反應的原子利用率為100% B.CH4→CH3COOH過程中,有C-H鍵發(fā)生斷裂 C.①→②放出能量并形成了C-C鍵 D.該催化劑可有效提高反應物的平衡轉化率 組卷:137引用:36難度:0.7
二、解答題(共4小題,滿分64分)
-
 15.一水硫酸四氨合銅晶體[Cu(NH3)4SO4?H2O,相對分子質量為246]是一種重要的染料及農藥中間體。常溫下該物質可溶于水,難溶于乙醇。某化學興趣小組通過以下實驗制備一水硫酸四氨合銅晶體并測定其純度。回答相關問題:
15.一水硫酸四氨合銅晶體[Cu(NH3)4SO4?H2O,相對分子質量為246]是一種重要的染料及農藥中間體。常溫下該物質可溶于水,難溶于乙醇。某化學興趣小組通過以下實驗制備一水硫酸四氨合銅晶體并測定其純度。回答相關問題:
Ⅰ.實驗室制取CuSO4溶液
方案i:銅與濃硫酸加熱制備。
方案ii:將銅粉在空氣中充分加熱至完全變黑,再加稀硫酸即可得到硫酸銅溶液。
(1)請寫出方案i反應的化學方程式,其缺點是(寫1點)。
(2)實際生產中方案ii常常有紫紅色固體未反應,猜想原因可能是。
(3)基于此,實驗進行了改進,其中一種方案是在硫酸和銅的反應容器中滴加H2O2溶液,觀察到的現象是(寫1點)。H2O2的沸點為150.2℃.為加快反應需要提高H2O2溶液的濃度,可通過圖將H2O2稀溶液濃縮,冷水入口是(填a或b),增加減壓設備的目的是。
Ⅱ.一水硫酸四氨合銅晶體的制備
(4)硫酸銅溶液含有一定的硫酸,呈酸性,加入適量NH3?H2O調節(jié)溶液pH,產生淺藍色沉淀,已知其成分為Cu2(OH)2SO4,試寫出生成此沉淀的離子反應方程式。
(5)繼續(xù)滴加NH3?H2O,會轉化成深藍色溶液。從深藍色溶液中析出深藍色晶體的簡便實驗是滴加。
Ⅲ.產品純度的測定
(6)精確稱取mg晶體,加適量水溶解,然后逐滴加入足量NaOH溶液,通入水蒸氣將氨全部蒸出,用V1mL0.200mol?L-1的鹽酸完全吸收。以甲基橙作指示劑,用0.200mol?L-1NaOH標準溶液滴定過剩的HCl,到終點時消耗V2mL NaOH溶液。產品純度的表達式為。組卷:101引用:4難度:0.5 -
16.“綠水青山就是金山銀山”,運用化學反應原理研究碳、氮、硫的單質及其化合物的反應對緩解環(huán)境污染、能源危機具有重要意義。
(1)CO還原NO的反應為2CO(g)+2NO(g)?2CO2(g)+N2(g)ΔH=-746kJ?mol-1。部分化學鍵的鍵能數據如下表(CO以C≡O鍵構成):
①由以上數據可求得NO的鍵能為化學鍵 C≡O N≡N C=O E/(kJ?mol-1) 1076 945 745 kJ?mol-1。
②寫出一條有利于提高NO平衡轉化率的措施。
(2)一定條件下,向某恒容密閉容器中充入xmolCO2和ymolH2,發(fā)生的反應CO2(g)+3H2(g)?CH3OH(g)+H2O(g)ΔH=-50kJ?mol
①如圖中能表示該反應的平衡常數K與溫度T之間的變化關系曲線為(填“a”或“b”)。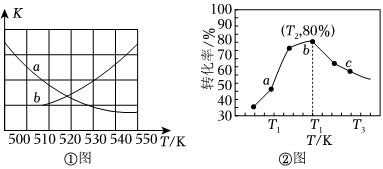
②若x=2、y=3,測得在相同時間內不同溫度下H2的轉化率如圖所示,則在該時間段內,恰好達到化學平衡時,此時容器內的壓強與反應開始時的壓強之比為。
(3)在有氧條件下,新型催化劑M能催化NH3與NOx反應生成N2。
①NH3與NO2生成N2的反應中,當生成28gN2時,轉移的電子的物質的量為mol(保留三位有效數字)。
②在有氧條件下,新型催化劑M能催化NH3與NO2反應生成N2。將一定比例的O2、NH3和NOx的混合氣體,勻速通入裝有催化劑M的反應器中反應(裝置如圖3)。
反應相同時間NOx的去除率隨反應溫度的變化曲線如圖4所示:在50-250℃范圍內隨著溫度的升高,NOx的去除率先迅速上升后上升緩慢的主要原因是。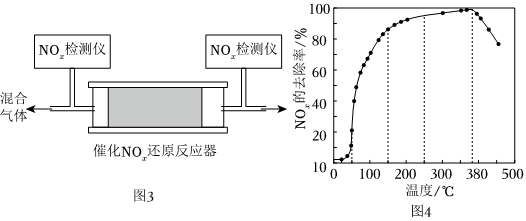 組卷:18引用:2難度:0.6
組卷:18引用:2難度:0.6


