2020-2021學年寧夏中衛市海原一中高三(上)期末化學試卷
發布:2024/4/20 14:35:0
一、選擇題(共7小題,每小題6分,滿分42分)
-
1.宋代《千里江山圖)描繪了山清水秀的美麗景色,歷經千年色彩依然,其中綠色來自孔雀石顏料[主要成分為Cu(OH)2?CuCO3],青色來自藍銅礦顏料[主要成分為Cu(OH)2?2CuCO3]。下列說法錯誤的是( )
A.保存《千里江山圖》需控制溫度和濕度 B.孔雀石、藍銅礦顏料不易被空氣氧化 C.孔雀石、藍銅礦顏料耐酸耐堿 D.Cu(OH)2?CuCO3中銅的質量分數高于Cu(OH)2?2CuCO3 組卷:821引用:29難度:0.6 -
2.設NA為阿伏加德羅常數值.下列有關敘述錯誤的是( )
A.14 g乙烯和丙烯混合氣體中的氫原子數為NA B.1 mol N2與4 mol H2反應生成的NH3分子數小于2NA C.1 mol Fe溶于過量硝酸,電子轉移數為3NA D.標準狀況下,2.24 L CH4含有的共價鍵數為0.4NA 組卷:306引用:80難度:0.9 -
3.根據下列實驗操作和現象所得到的結論正確的是( )
選項 實驗操作和現象 結論 A 向淀粉溶液中加適量20% H2SO4溶液,加熱,冷卻后加NaOH溶液至中性,再滴加少量碘水,溶液變藍 淀粉未水解 B 室溫下,向0.1mol?L-1HCl溶液中加入少量鎂粉,產生大量氣泡,測得溶液溫度上升 鎂與鹽酸反應放熱 C 室溫下,向濃度均為0.1mol?L-1的BaCl2和CaCl2混合溶液中加入Na2CO3溶液,出現白色沉淀 白色沉淀是BaCO3 D 向0.1mol?L-1H2O2溶液中滴加0.01mol?L-1KMnO4溶液,溶液褪色 H2O2具有氧化性 A.A B.B C.C D.D 組卷:533引用:10難度:0.5
非選擇題:共58分,第8-10題為必考題,每個試題考生都必須作答。第11-12題為選考題,考生根據要求作答。(一)必考題:共43分。
-
10.氮是地球上含量豐富的一種元素,氮及其化合物在工農業生產、生活中有著重要作用,合成氨工業在國民生產中有重要意義。以下是關于合成氨的有關問題,請回答:
(1)若在一容積為2L的密閉容器中加入0.2mol的N2和0.6mol的H2在一定條件下發生反應:N2(g)+3H2(g)?2NH3(g)△H<0,若在5分鐘時反應達到平衡,此時測得NH3的物質的量為0.2mol。則前5分鐘的平均反應速率v(H2)=。平衡時H2的轉化率為%。
(2)下列能判定(1)中合成氨反應到達平衡狀態的是。
A.容器內壓強保持不變
B.容器內混合氣體的密度保持不變
C.容器內混合氣體的平均相對分子質量保持不變
D.V(N2):V(H2)=1:3
E.單位時間內每斷裂3mol H-H,同時形成6mol N-H
(3)平衡后,若提高H2的轉化率,可以采取的措施有。
A.加了催化劑
B.增大容器體積
C.降低反應體系的溫度
D.加入一定量N2
(4)若在0.5L的密閉容器中,一定量的氮氣和氫氣進行如下反應:N2(g)+3H2(g)?2NH3(g)△H<0,其化學平衡常數K與溫度T的關系如表所示。
請完成下列問題:T/℃ 200 300 400 K K1 K2 0.5
①試比較K1、K2的大小,K1K2。(填“<”、“>”或“=”)
②400℃時,反應2NH3(g)?N2(g)+3H2(g)的化學平衡常數為。當測得NH3、N2和H2物質的量分別為3mol、2mol和1mol時,則該反應的v(N2)正v(N2)逆。(填“<”、“>”或“=”)。組卷:10引用:1難度:0.6
(二)選考題:共15分。請考生從2道化學題題中每科任選一題作答。如果多做,則每學科按所做的第一題計分。
-
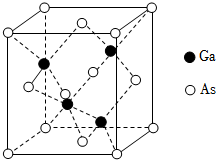 11.碑化鎵(GaAs)是優良的半導體材料,可用于制作微型激光器或太陽能電池的材料等。
11.碑化鎵(GaAs)是優良的半導體材料,可用于制作微型激光器或太陽能電池的材料等。
試回答下列問題
(1)寫出基態As原子的核外電子排布式。
(2)根據元素周期律,原子半徑CaAs(填“>”或“<”下同),第一電離能CaAs
(3)AsCl5分子的立體構型為,其中As的雜化軌道類型為。
(4)CaF3的熔點高于1000℃,GaCl3的熔點為79℃,其原因是。
(5)GaAs的熔點為1238℃,其晶胞結構如圖所示。該晶體的類型為,
與As以鍵鍵合。已知阿伏加德羅常數為NA,晶胞參數α=1mm,此晶體的密度為g?cm-3(寫出計算式)。組卷:40引用:2難度:0.5


