2021-2022學年湖南省長沙市長郡中學高一(下)期末化學試卷
發布:2024/4/20 14:35:0
一、選擇題(本題包括10小題,每小題3分,共30分。在每小題給出的四個選項中,只有一項是符合題目要求的)
-
1.2022年2月,萬眾矚目的第二十四屆冬季奧林匹克運動會在北京舉辦。下列物質屬于有機化合物的是( )
A.火炬使用的燃料--氫氣 B.頒獎禮儀服裝中添加的石墨烯發熱材料 C.速滑競賽服中大腿部位使用的高彈性橡膠材料 D.用來打造國家速滑館“冰絲帶”的超臨界二氧化碳 組卷:61引用:4難度:0.8 -
2.向燒杯中加入25mL蒸餾水,加熱至沸騰,向沸水中逐滴加入6滴FeCl3飽和溶液,繼續加熱至液體呈紅棕色,停止加熱,就制得了Fe(OH)3膠體。有關膠體的敘述不正確的是( )
A.膠體是一種分散系,屬于混合物 B.膠體的本質特征是能發生丁達爾效應 C.膠體分散質粒子直徑介于1~100nm之間 D.滲析是分離膠體和溶液的一種常用方法 組卷:32引用:2難度:0.7 -
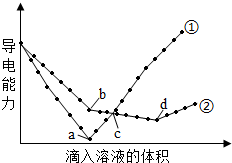 3.在兩份相同的Ba(OH)2溶液中,分別滴入物質的量濃度相等的H2SO4、NaHSO4溶液,其導電能力隨滴入溶液體積變化的曲線如圖所示。下列分析不正確的是( )
3.在兩份相同的Ba(OH)2溶液中,分別滴入物質的量濃度相等的H2SO4、NaHSO4溶液,其導電能力隨滴入溶液體積變化的曲線如圖所示。下列分析不正確的是( )A.①代表滴加H2SO4溶液的變化曲線 B.b點,溶液中大量存在的離子是Na+、OH- C.c點,兩溶液中含有相同量的OH- D.a、d兩點對應的溶液均顯中性 組卷:118引用:28難度:0.7 -
4.三效催化劑是最為常見的汽車尾氣催化劑,其催化劑表面物質轉化的關系如圖所示,下列說法正確的是( )
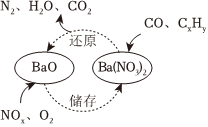
A.在轉化過程中,氮元素均被還原 B.依據圖示判斷催化劑不參與儲存和還原過程 C.還原過程中生成0.1molN2,轉移電子數為0.5mol D.三效催化劑能有效實現汽車尾氣中CO、CxHy、NOx三種成分的凈化 組卷:221引用:24難度:0.7 -
5.用如圖所示實驗裝置進行相關實驗探究,其中裝置不合理的是( )
A. 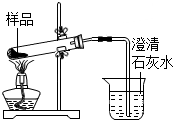
鑒別純堿與小蘇打B. 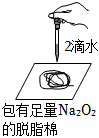
證明Na2O2與水反應放熱C. 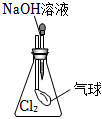
證明Cl2能與燒堿溶液反應D. 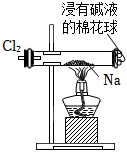
探究鈉與Cl2反應組卷:232引用:38難度:0.6 -
6.A、B、C、D、E五種短周期主族元素,它們的原子序數依次增大.已知:A和C、B和D分別位于同主族,且B、D質子數之和是A、C質子數之和的2倍.下列說法正確的是( )
A.原子半徑的大小順序:r(B)>r(C)>r(D) B.C的最高價氧化物對應水化物的堿性在同周期中最強 C.E分別與A、C形成的化合物中化學鍵類型相同 D.B的簡單氣態氫化物的熱穩定性比D的弱 組卷:19引用:3難度:0.7
三、非選擇題(本題包括4小題,共54分)
-
17.鐵及其化合物之間的相互轉化可用下式表示:Fe2+
Fe3+①②③④。FeO2-4
(1)Fe與過量稀硫酸反應可以制取FeSO4。若用反應所得的酸性溶液實現上述①的轉化,要求產物純凈,可選用的試劑是(填標號)。
a.Cl2
b.Fe
c.HNO3
d.H2O2
(2)檢驗硫酸鐵溶液中存在Fe2+的方法是。
(3)配平下面的缺項方程式:FeCl3+Cl2+═Na2 FeO4+NaCl+H2O。
(4)某同學用含有Fe2+、Fe3+的溶液A制備磁性Fe3O4膠體粒子,并測定產物中鐵元素的含量,過程如圖。已知:反應中K2Cr2O7被還原為Cr3+。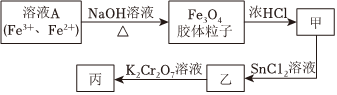
①寫出由溶液A制備磁性Fe3O4膠體粒子的離子方程式:。
②由溶液A制得Fe3O4膠體粒子的過程中,需持續通入N2,其原因是。
③SnCl2溶液的作用是。
④寫出酸性條件下,乙→丙的離子方程式:。組卷:25引用:2難度:0.7 -
18.某化學課外興趣小組用如圖所示裝置進行實驗,制備某氣體并驗證其性質。請回答下列問題:

(1)若裝置A中分液漏斗盛裝濃硫酸,圓底燒瓶盛裝銅片。
①裝置A中發生反應的化學方程式為。
②實驗中,取一定質量的銅片和一定體積18mol?L-1的濃硫酸在圓底燒瓶中共熱,直到反應完畢,發現燒瓶中還有銅片剩余,該小組學生根據所學的化學知識認為還有一定量的硫酸剩余。
a.有一定量的余酸但未能使銅片完全溶解,你認為原因是。
b.下列藥品中能用來證明反應結束后的燒瓶中確有余酸的是(填標號)。
A.鐵粉
B.BaCl2溶液
C.銀粉
D.NaHCO3溶液
(2)若裝置A中分液漏斗盛裝濃硫酸,圓底燒瓶盛裝木炭。
①裝置A中發生反應的化學方程式為。
②設計實驗證明裝置C中含有CO2時,所需的試劑有(填標號)。
aNaOH溶液
b.澄清石灰水
c.品紅溶液
d.濃溴水
e.酸性KMnO4溶液
(3)若裝置A中分液漏斗盛裝濃鹽酸,圓底燒瓶盛裝MnO2粉末。
①裝置B的作用是貯存多余的氣體。當D處有明顯的現象后,關閉止水夾K并移去酒精燈,但由于余熱的作用,A處仍有氣體產生,此時B中現象是。
②D中品紅溶液的現象為,加熱試管時溶液的現象為。
(4)裝置D中試管口放置的棉花中浸了一種液體,可適用于(1)(2)(3)小題中實驗,該液體是。組卷:48引用:4難度:0.6


