2021-2022學年江西省九江一中高二(上)期末化學試卷
發布:2024/4/20 14:35:0
一、選擇題:每小題只有一個選項符合題意,每題2分,共50分)
-
1.下列裝置工作時,將化學能轉化為電能的是( )
A. 
B. 
C. 
D.  組卷:6引用:4難度:0.7
組卷:6引用:4難度:0.7 -
2.證明氨水是弱堿的事實是( )
A.氨水與硫酸發生中和反應 B.氨水能使紫色石蕊試液變藍 C.0.1mol/L的NH4Cl溶液的pH值為5.1 D.銨鹽與熟石灰反應逸出氨氣 組卷:54引用:4難度:0.9 -
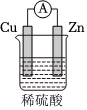 3.關于如圖所示裝置的敘述,正確的是( )
3.關于如圖所示裝置的敘述,正確的是( )A.銅是負極,銅片上有氣泡產生 B.銅片質量逐漸減少 C.電流從鋅片經導線流向銅片 D.氫離子在銅片表面被還原 組卷:133引用:9難度:0.9 -
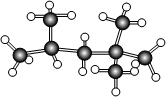 4.“辛烷值”用來表示汽油的質量,汽油中異辛烷的爆震程度最小,將其辛烷值標定為100,如圖是異辛烷的球棍模型,則異辛烷的系統命名為( )
4.“辛烷值”用來表示汽油的質量,汽油中異辛烷的爆震程度最小,將其辛烷值標定為100,如圖是異辛烷的球棍模型,則異辛烷的系統命名為( )A.1,1,3,3-四甲基丁烷 B.2,3,4-三甲基戊烷 C.2,4,4-三甲基戊烷 D.2,2,4-三甲基戊烷 組卷:75引用:6難度:0.7 -
5.下列方程式中,屬于水解反應的是( )
A.H2O+H2O?H3O++OH- B.HCO3-+OH-?CO32-+H2O C.HCO3-+H2O?H3O++CO32- D.CO32-+H2O?HCO3-+OH- 組卷:100引用:1難度:0.8 -
6.下表中物質的分類組合完全正確的是( )
選項 A B C D 強電解質 KNO3 膽礬 BaSO4 HClO4 弱電解質 HF CaCO3 HClO NH3 非電解質 SO2 金屬Al H2O C2H5OH A.A B.B C.C D.D 組卷:193引用:3難度:0.8 -
7.常溫下,在由水電離出的c(H+)=10-13mol?L-1的溶液中,一定能大量共存的離子組是( )
A.K+、Na+、HCO3-、Cl- B.K+、Fe3+、Br-、I- C.Na+、Cl-、NO3-、SO42- D.NH4+、Al3+、Cl-、SO42- 組卷:5引用:1難度:0.7 -
8.下列實驗操作能達到實驗目的的是( )
A.用廣泛pH試紙測得溶液的pH為2.3 B.用滴加少量硫酸銅溶液的稀硫酸跟鋅粒反應可以加快制取氫氣的速率 C.用酚酞溶液區分稀鹽酸和食鹽水 D.將兩根碳棒用導線相連接分別插入用鹽橋相連的氯化鐵溶液和氯化鉀溶液中有電流產生 組卷:5引用:2難度:0.6 -
9.實驗室現有3種指示劑,其pH變色范圍如下:甲基橙:3.1~4.4石蕊:5.0~8.0酚酞:8.2~10.0用0.1000mol/LNaOH溶液滴定未知濃度的CH3COOH溶液,反應恰好完全時,下列敘述中正確的是( )
A.溶液呈中性,可選用石蕊或酚酞作指示劑 B.溶液呈中性,必選用石蕊作指示劑 C.溶液呈堿性,可選用甲基橙或酚酞作指示劑 D.溶液呈堿性,可選用酚酞作指示劑 組卷:62引用:1難度:0.7 -
10.下列說法正確的是( )
A.將FeCl3溶液和Fe2(SO4)3溶液分別加熱、蒸干、灼燒,所得固體成分相同 B.配制FeSO4溶液時,將FeSO4固體溶于稀鹽酸中,然后稀釋至所需濃度 C.用加熱的方法可以除去K2SO4溶液中的Fe3+ D.洗滌油污常用熱的碳酸鈉溶液 組卷:35引用:2難度:0.5
二、填空題(共50分)
-
30.2013年初,霧霾天氣多次肆虐天津、北京等地區.其中,燃煤和汽車尾氣是造成空氣污染的原因之一.
(1)汽車尾氣凈化的主要原理為:2NO(g)+2CO(g)2CO2(g)+N2(g).ΔH<0催化劑
①該反應平衡常數表達式.
②若該反應在絕熱、恒容的密閉體系中進行,下列示意圖正確且能說明反應在進行到t1時刻達到平衡狀態的是(填代號).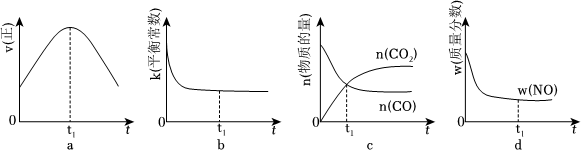
(2)直接排放煤燃燒產生的煙氣會引起嚴重的環境問題.
煤燃燒產生的煙氣含氮的氧化物,用CH4催化還原NOX可以消除氮氧化物的污染.
已知:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)ΔH=-867kJ/mol
2NO2(g)?N2O4(g)ΔH=-56.9kJ/mol
H2O(g)═H2O(l)ΔH=-44.0kJ/mol
寫出CH4催化還原N2O4(g)生成N2和H2O(l)的熱化學方程式:.
(3)甲烷燃料電池可以提升能量利用率.如圖是利用甲烷燃料電池電解100mL 1mol/L食鹽水,電解一段時間后,收集到標準狀況下的氫氣2.24L(設電解后溶液體積不變).
①甲烷燃料電池的負極反應式:.
②電解后溶液的pH=(忽略氯氣與氫氧化鈉溶液反應).
③陽極產生氣體的體積在標準狀況下是L.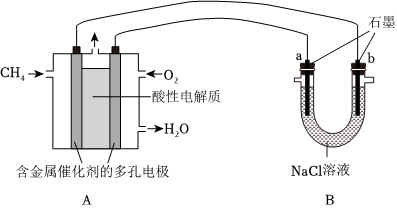 組卷:50引用:5難度:0.5
組卷:50引用:5難度:0.5 -
31.某溫度下,2H2(g)+CO(g)?CH3OH(g)的Kp=6.0×10-3(kPa)-2(用平衡分壓代替平衡濃度所得平衡常數,分壓=總壓×物質的量分數).該溫度下的某容器中,若起始充入2molH2、1molCO,平衡時甲醇的平衡分壓p(CH3OH)=24.0kPa,則平衡時混合氣體中CO的體積分數約為
%(小數點后保留1位).組卷:16引用:1難度:0.6


