2021-2022學年上海市曹楊二中高一(下)期末化學試卷
發布:2025/1/7 13:0:3
一、選擇題(共30小題)
-
1.下列物質中,既能與鹽酸反應又能與NaOH溶液反應的是( )
①NaHCO3②Al③Al2O3④Al(OH)3⑤(NH4)2CO3A.②③④ B.①③④ C.①②③④ D.全部 組卷:27引用:3難度:0.8 -
2.關于氮肥的下列說法中,不正確的是( )
A.銨態氮肥不可與堿性物質混合使用 B.尿素是肥效最高的銨態氮肥 C.碳銨的使用應深施蓋土 D.長期使用硫酸銨易導致土壤酸化板結 組卷:78引用:2難度:0.7 -
3.化學與人類生活、社會可持續發展密切相關,下列說法錯誤的是( )
A.“神舟十三號”運載火箭的軌道艙殼體鋁合金因其密度小、抗腐蝕性能好等優點成為關鍵材料 B.中科院首次實現了CO2合成淀粉,該技術的應用有助于實現“碳達峰”和“碳中和” C.燃煤中加入CaO主要是為了減少溫室氣體的排放和酸雨的形成 D.T-碳是一種新型三維碳結構晶體,與金剛石互為同素異形體 組卷:33引用:2難度:0.7 -
4.“類推”是一種重要的學習方法。下列類推的結論與事實不相符的是( )
A.由MgCO3微溶于水,推知Li2CO3微溶于水 B.由Al(OH)3有兩性,推知Be(OH)2有兩性 C.由Cl2與水反應生成HCl和HClO,推知F2與水反應生成HF和HFO D.由N元素的最高正價是+5,推知P元素的最高正價是+5 組卷:25引用:3難度:0.7 -
 5.如圖所示進行實驗,下列說法錯誤的是( )
5.如圖所示進行實驗,下列說法錯誤的是( )A.裝置甲中鋅片上產生氣泡而裝置乙中銅片上產生氣泡 B.裝置甲中不產生電流,裝置乙中電流由銅片流出經溶液流向鋅片 C.若其他條件不變,則相同時間內,裝置乙中鋅片減少的質量比裝置甲的大 D.裝置乙中負極的電極反應式:Zn-2e-═Zn2+ 組卷:40引用:2難度:0.7 -
6.下列說法不正確的是( )
A.化石能源是指煤、石油、天然氣為主的能源,是可再生能源 B.用雜草、生活垃圾等有機廢棄物在沼氣池中發酵產生沼氣,是一種清潔能源 C.鋅錳干電池是一種常用的一次電池 D.由于電池制造工藝等方面不足,充電電池的充放電次數有限 組卷:48引用:2難度:0.7 -
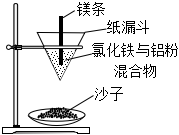 7.野外焊接鋼軌常用如圖所示裝置,鎂條引燃混合物后,反應非常劇烈,火星四射,有熔融鐵珠落入沙子中。下列敘述錯誤的是( )
7.野外焊接鋼軌常用如圖所示裝置,鎂條引燃混合物后,反應非常劇烈,火星四射,有熔融鐵珠落入沙子中。下列敘述錯誤的是( )A.該反應屬于置換反應 B.有“熔融鐵珠”生成說明該反應為放熱反應 C.該反應的化學能全部轉化為熱能 D.該反應中生成物的總能量小于反應物的總能量 組卷:66引用:1難度:0.7 -
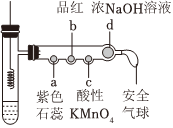 8.若將銅絲插入熱濃硫酸中進行如圖(a~d均為浸有相應試液的棉花)所示的探究實驗,下列分析正確的是( )
8.若將銅絲插入熱濃硫酸中進行如圖(a~d均為浸有相應試液的棉花)所示的探究實驗,下列分析正確的是( )A.Cu與濃硫酸反應,只體現H2SO4的酸性 B.a處變紅,說明SO2是酸性氧化物 C.b或c處褪色,均說明SO2具有漂白性 D.試管底部出現白色固體,說明反應中無H2O生成 組卷:845引用:3難度:0.5 -
9.下列說法正確的是( )
A.濃硫酸具有強氧化性,常溫下可與鐵單質劇烈反應 B.氮氧化物與“光化學煙霧”、“臭氧空洞”的形成有關 C.氮的固定只有在高溫、高壓、有催化劑存在的條件下才能實現 D.硝酸是強酸,可以用鋅和稀硝酸反應制備氫氣 組卷:50引用:2難度:0.5 -
10.下列關于濃硫酸的說法正確的是( )
A.金屬銅在常溫下放入濃硫酸中無現象,是因為濃硫酸把銅鈍化了 B.100mL18mol?L-1的濃硫酸和足量Cu在加熱條件下反應生成0.9molSO2 C.蔗糖和濃硫酸的“黑面包”實驗中,濃硫酸主要體現了脫水性和強氧化性 D.濃硫酸和C單質在加熱條件下反應,反應中濃硫酸既體現出酸性,又體現出氧化性 組卷:128引用:3難度:0.5 -
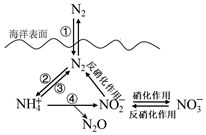 11.海洋中無機氮的循環過程可用如圖表示。下列關于海洋中的氮循環的說法不正確的是( )
11.海洋中無機氮的循環過程可用如圖表示。下列關于海洋中的氮循環的說法不正確的是( )A.過程①涉及分子間作用力的破壞和化學鍵的生成 B.過程②屬于固氮作用 C.硝化作用是氮元素發生了氧化反應 D.向海洋中排放含NO3-的廢水會增強反硝化作用 組卷:77引用:3難度:0.5 -
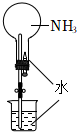 12.常溫常壓下,1體積水能溶解約700體積NH3.用如圖所示裝置進行實驗,下列說法正確的是( )
12.常溫常壓下,1體積水能溶解約700體積NH3.用如圖所示裝置進行實驗,下列說法正確的是( )A.擠壓滴管并打開止水夾后,觀察到燒杯中的水倒吸,產生紅色“噴泉” B.“噴泉”的產生能證明NH3與H2O發生了反應 C.若將NH3換成CO2,也能產生明顯的“噴泉” D.實驗后,取出燒瓶中的溶液,測得其pH>7,原因是:NH3+H2O?NH3?H2O,NH3?H2O?NH4++OH- 組卷:153引用:2難度:0.5
二、綜合分析題(共40分)
-
36.化學反應速率與平衡:
2022年4月16日,中國空間站的3名航天員乘神舟十三號載人飛船平安返回地球。
空間站處理CO2的一種重要方法是對CO2進行收集和再生處理,重新生成可供人體呼吸的氧氣。其技術路線可分為以下三步:
①固態胺吸收與濃縮CO2在水蒸氣存在下固態胺吸收CO2反應生成酸式碳酸鹽(放熱反應),再解吸出CO2的簡單方法是。
②CO2的加氫甲烷化H2還原CO2制CH4的反應如下:CO2(g)+4H2(g)?CH4(g)+2H2O(g)(放熱反應)
。有利于提高甲烷平衡產率的反應條件是(寫一種)。組卷:10引用:2難度:0.7 -
37.NO2(紅棕色)和N2O4(無色)之間發生反應:N2O4(g)?2NO2(g)。將一定量N2O4氣體充入體積為2L的恒容密閉容器中,控制反應溫度為T。
①該反應為吸熱反應,則反應物的化學鍵斷裂要吸收的能量(填“>”、“<”或“=”)生成物的化學鍵形成要放出的能量。
②下列可以說明該反應達到平衡的是。
A.c(N2O4):c(NO2)=1:2
B.v正(N2O4)=2v逆(NO2)
C.容器內氣體的顏色不再變化
D.混合氣體的壓強不再變化
③在溫度為T的條件下,向該恒容密閉容器中充入0.04mol?L-1N2O4,c(NO2)隨時間的變化曲線如圖所示: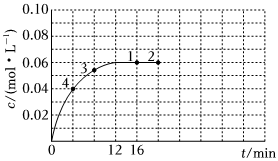
i.在圖中畫出0~16min時間段內,c(N2O4)隨時間的變化曲線。
ii.1~4四個點中,v正=v逆的點有。
iii.反應進行到16min時,N2O4的轉化率是%。組卷:20引用:2難度:0.5


