2023年新疆烏魯木齊101中高考化學質檢試卷(2月份)
發布:2024/11/2 6:0:2
一、單項選擇題(15題每題3分共45分)
-
1.化學與資源利用、環境保護及社會可持續發展密切相關,下列說法錯誤的是( )
A.明礬常用作凈水劑,是因為明礬具有殺菌消毒的功能 B.研發催化劑將CO2還原為甲醇有利于促進碳中和 C.推廣使用新能源汽車有利于減少霧霾 D.天和核心艙的可折疊柔性太陽翼電池能將光能轉化為電能 組卷:14引用:2難度:0.7 -
2.化學分析的手段通常有定性分析、定量分析、儀器分析等,現代化學中儀器分析是研究物質結構的基本方法和實驗手段。下列儀器分析手段的運用科學可行的是( )
A.光譜分析:利用原子光譜上的特征譜線來鑒定元素 B.質譜分析:利用質荷比來測定分子立體結構 C.紅外光譜分析:利用分子吸收與化學鍵振動頻率相同的紅外線來測定晶體晶型 D.X-衍射圖譜分析:利用X-射線透過物質時記錄的分立斑點或譜線來測定分子結構 組卷:69引用:2難度:0.7 -
3.下列金屬的冶煉過程中,需加入還原劑的是( )
A.HgO-→Hg B.Al2O3-→Al C.Ag2O-→Ag D.CuSO4-→Cu 組卷:12引用:3難度:0.7 -
4.關于微粒在指定溶液中能否大量共存的評價正確的是( )
選項 溶液 微粒 評價 A 8%H2O2水溶液 Fe3+、Mg2+、SO42-、Na+ 可以大量共存 B 室溫下pH=12的水溶液 NO3-、Na+、SO32-、K+ NO3-能將SO32-氧化而不能大量共存 C 1mol?L-1的NH4Cl溶液 Ba2+、OH-、NH3?H2O NH4Cl溶液顯酸性,NH3?H2O不能大量共存 D NaHSO4水溶液 I-、K+、CH3COO-、Br- CH3COO-能與NaHSO4溶液反應,不能大量共存 A.A B.B C.C D.D 組卷:59引用:1難度:0.7 -
5.“琴棋書畫”被譽為中國四大古老的文化藝術,常用來表示個人的文化素養。下列“琴棋書畫”實物中,主要由無機非金屬材料制成的是( )




A.蠶絲琴弦 B.釉瓷棋子 C.豬鬃毛筆 D.宣紙畫卷 A.A B.B C.C D.D 組卷:30引用:2難度:0.7 -
6.化學科學在國防裝備的打造中發揮著重要作用.下列有關敘述錯誤的是( )
A.戰機機身大量采用了碳纖維材料,對比傳統金屬材質,碳纖維密度小、強度高 B.隱形戰機表面的吸波陶瓷——碳化硅屬于分子晶體 C.曳光彈尾部的曳光劑中加入銅鹽,曳光彈可發出綠光 D.涂在裝甲車上的聚氨酯偽裝涂料屬于有機高分子材料 組卷:29引用:2難度:0.9
二、綜合題(共55分)
-
18.鎵是制作高性能半導體的重要原料。在工業上經常從鋅礦冶煉的廢渣中回收鎵。已知鋅礦渣中含有Zn、Fe、Pb、Ga以及二氧化硅等,目前綜合利用鋅礦渣的流程如圖:
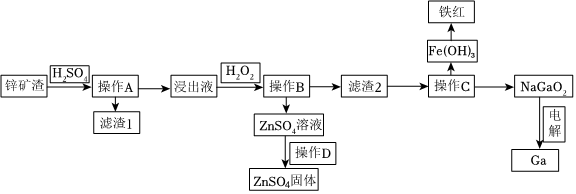
已知:①Ga性質與鋁相似。
②lg2=0.3,lg3=0.48。
③如下表所示。
(1)寫出Ga的原子結構示意圖Zn(OH)2 Ga(OH)3 Fe(OH)2 Fe(OH)3 Ksp 1.6×10-17 2.7×10-31 8×10-16 2.8×10-39 。
(2)濾渣1的成分為。
(3)加入H2O2的目的( 用離子方程式和適當語言回答)。
(4)室溫條件下,若浸出液中各種陽離子的濃度均為0.01mol/L且某種離子濃度小于1×10-5mol/L即認為該離子已完全除去,問操作B調節pH的范圍是。
(5)操作C中,需要加入氫氧化鈉溶液,其目的是(用離子方程式解釋);能否用氨水代替NaOH溶液,為什么?;如何檢測Fe(OH)3洗滌干凈?。
(6)在工業上,經常用電解NaGaO2溶液的方法生產Ga,寫出陰極的電極反應方程式:。組卷:26引用:1難度:0.5 -
19.鋁是地殼中含量最高的金屬元素,其單質及合金在生產生活中的應用日趨廣泛.
(1)真空碳熱還原氯化法可實現由鋁土礦制備金屬鋁,其相關反應的熱化學方程式如下:
Al2O3(s)+AlCl3(g)+3C(s)═3AlCl(g)+3CO(g)△H=a kJ?mol-1
3AlCl(g)═2Al(l)+AlCl3(g)△H=b kJ?mol-1
①反應Al2O3(s)+3C(s)═2Al(l)+3CO(g)的△H=kJ?mol-1(用含a、b的代數式表示).
②Al4C3是反應過程中的中間產物.Al4C3與鹽酸反應(產物之一是含氫量最高的烴)的化學方程式為.
(2)鎂鋁合金(Mg17Al12)是一種潛在的貯氫材料,可在氬氣保護下,將一定化學計量比的Mg、Al單質在一定溫度下熔煉獲得.該合金在一定條件下完全吸氫的反應方程式為Mg17Al12+17H2═17MgH2+12Al.得到的混合物Y(17MgH2+12Al)在一定條件下可釋放出氫氣.
①熔煉制備鎂鋁合金(Mg17Al12)時通入氬氣的目的是.
②在6.0mol?L-1HCl溶液中,混合物Y能完全釋放出H2.1mol Mg17Al12完全吸氫后得到的混合物Y與上述鹽酸完全反應,釋放出H2的物質的量為.
③在0.5 mol?L-1NaOH和1.0 mol?L-1MgCl2溶液中,混合物Y均只能部分放出氫氣,反應后殘留固體物質X-射線衍射譜圖如下圖所示(X-射線衍射可用于判斷某晶態物質是否存在,不同晶態物質出現衍射峰的衍射角不同).在上述NaOH溶液中,混合物Y中產生氫氣的主要物質是(填化學式).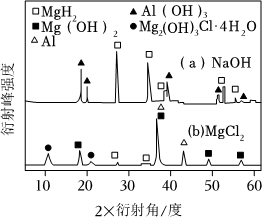
(3)鋁電池性能優越,Al-AgO電池可用作水下動力電源,其原理如右下圖(圖2)所示.該電池反應的化學方程式為:.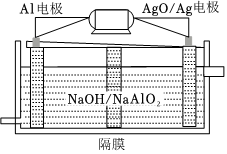 組卷:149引用:2難度:0.1
組卷:149引用:2難度:0.1


