2021-2022學年河北省張家口市宣化一中高二(上)期中化學試卷
發布:2024/4/20 14:35:0
一、選擇題:本題包括9小題,每小題3分,共27分。在每小題給出的四個選項中,只有一項是符合題目要求的。
-
1.古代詩詞中蘊含著許多科學知識,下列敘述正確的是( )
A.“冰,水為之,而寒于水”說明等質量的水和冰相比,冰的能量更低 B.于謙《石灰吟》“千錘萬鑿出深山,烈火焚燒若等閑”,描述的石灰石煅燒是放熱反應 C.曹植《七步詩》“煮豆燃豆萁,豆在釜中泣”,這里的變化只有化學能轉化為熱能 D.蘇軾《石炭?并引》“投泥潑水愈光明,爍玉流金見精悍”,所指高溫時碳與水蒸氣反應為放熱反應 組卷:31引用:7難度:0.7 -
2.制備水煤氣的反應C(s)+H2O(g)?H2(g)+CO(g)ΔH>0,下列說法正確的是( )
A.該反應ΔS<0 B.升高溫度,正反應速率增大,逆反應速率減小 C.恒溫下,增大總壓,H2O(g)的平衡轉化率不變 D.恒溫恒壓下,充入CO氣體,平衡常數不變 組卷:11引用:1難度:0.5 -
3.下列有關生活生產中的敘述合理的是( )
A.水庫的鋼閘門與電源負極相連以防止其生銹,此為犧牲陽極的陰極保護法 B.明礬和漂白粉用于自來水的凈化和殺菌消毒,兩者的作用原理相同 C.銅的精煉工業和電鍍銅工業,均可采用CuSO4溶液做電解質溶液 D.硫酸工業中SO2轉化為SO3時采用常壓,是因為增大壓強不會提高SO2的轉化率 組卷:9引用:1難度:0.7 -
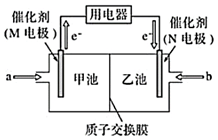 4.一種應用比較廣泛的甲醇燃料電池,電解液是酸性溶液,其工作原理如圖所示,下列說法正確的是( )
4.一種應用比較廣泛的甲醇燃料電池,電解液是酸性溶液,其工作原理如圖所示,下列說法正確的是( )A.若有1molCO2生成,則有6molH+從甲池通過交換膜進入乙池 B.N極電極反應為O2+4H+-4e-═2H2O C.甲池溶液pH增大,乙池溶液pH減小 D.M極為負極,發生還原反應 組卷:17引用:1難度:0.7 -
5.下列說法不正確的是( )
A.中和相同體積、相同濃度的醋酸和鹽酸,所需NaOH的物質的量相同 B.常溫下,濃度均為0.1mol?L-1的氨水和NaOH溶液中,NaOH溶液的導電能力更強 C.常溫下,pH<7的溶液一定是酸溶液 D.向NaOH溶液中滴加醋酸至c(CH3COO-)=c(Na+),則溶液呈中性 組卷:3引用:1難度:0.7
三、解答題(本大題共4小題,共57分)
-
16.影響化學反應速率的因素有很多,某課外興趣小組用實驗的方法對其進行探究。
(1)實驗一:取3mol?L-1的H2O2溶液各10mL分別進行下列實驗,實驗報告如表所示。
①實驗1、2研究的是序號 V(過氧化氫溶液)/mL V(氯化鐵溶液)/mL 二氧化錳質量/g 反應溫度/℃ V(水)/mL 結論 1 10 2 0 50 8 2 10 2 0 30 8 3 10 0 1 30 a 對H2O2分解速率的影響。
②表中數據a的值應該為;實驗2、3研究的是對H2O2分解速率的影響。
③如果實驗3中30s時共收集到氣體的體積為11.2mL(已折算成標準狀況下),則用過氧化氫表示的0~30s的平均反應速率為mol?L-1?min-1。
(2)實驗二:查文獻可知,Cu2+對H2O2分解也有催化作用,為比較Fe3+、Cu2+對H2O2分解的催化效果,該小組的同學分別設計了如圖甲、乙所示的實驗。回答相關問題: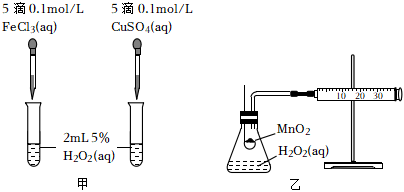
①定性分析:如圖甲可通過觀察,定性比較得出結論。有同學提出將CuSO4溶液改為CuCl2溶液更合理,其理由是。
②定量分析:如圖乙所示,實驗時以收集到40mL氣體為準,忽略其他可能影響實驗的因素,實驗中需要測量的數據是。
(3)①H2O2溶液在Fe3+催化下分解的反應歷程如下:
第一步反應歷程為:2Fe3++H2O2=2Fe2++O2+2H+
第二步反應歷程為:;
②該小組預測同為第四周期Ⅷ族的Fe、Co、Ni可能有相似的催化作用。查閱資料:CoxNi(1-x)Fe2O4(其中Co、Ni均為+2價)也可用作H2O2分解的催化劑,具有較高的活性。如圖丙表示兩種不同方法制得的催化劑CoxNi(1-x)Fe2O4在10℃時催化分解6%的H2O2溶液的相對初始速率隨x變化曲線。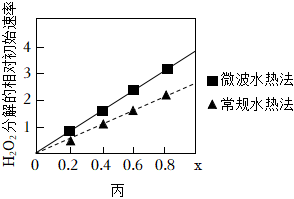
a.由圖中信息可知法制取得到的催化劑活性更高。
b.推測Co2+、Ni2+兩種離子中催化效果更好的是。組卷:6引用:2難度:0.6 -
17.利用催化氧化反應將SO2轉化為SO3是工業上生產硫酸的關鍵步驟。已知:SO2(g)+
O2(g)?SO3(g)ΔH=-98kJ?mol-1。12
(1)該反應平衡常數K的表達式為;溫度降低,平衡常數K(填“增大”、“不變”或“減小”)。
(2)某溫度下該反應的平衡常數K=6,若在此溫度下,向2L的恒容密閉容器中,充入4molSO2(g)、2molO2(g)和4molSO3(g),則反應開始時v(正)v(逆)(填“<”“>”或“=”)。
(3)在溫度和容積不變的條件下,能說明該反應已達平衡狀態的是(填寫序號字母)。
a.n(SO2):n(O2):n(SO3)=2:1:2
b.容器內壓強保持不變
c.生成SO3的速率與消耗SO2的速率相等
d.容器內的密度保持不變
(4)向2L的恒容密閉容器中,重新充入2molSO2和1molO2,測得SO2的物質的量隨時間變化如下表所示。
①從反應開始到5min末,用O2濃度變化表示的平均反應速率v(O2)=t/min 0 2 5 10 15 n(SO2)/mol 2 1.5 1 0.5 0.5 。達到平衡時,SO2的平衡轉化率為。
②上述反應達到平衡后,改變下列條件能使反應速率增大,且平衡向正反應方向移動的是(填寫序號字母)。
a.及時分離出SO3
b.適當升高溫度
c.再充入2molSO2和1molO2
d.選擇高效的催化劑組卷:8引用:4難度:0.7


