2022-2023學年湖南師大附中高三(上)月考化學試卷(二)
發布:2025/1/2 16:0:3
一、選擇題:本題共10小題,每小題3分,共30分。每小題只有一個選項符合題目要求。
-
1.化學使科技進步,使生活更美好。下列相關說法錯誤的是( )
A.“海牛Ⅱ號”刷新世界鉆探深度,鉆頭采用硬質合金材料,其硬度高于成分金屬 B.食品包裝袋中常有硅膠、生石灰、還原鐵粉等,其作用都是防止食品氧化變質 C.北斗衛星導航系統由中國自主研發、獨立運行,其所用芯片的主要成分為高純硅 D.“神舟14號”宇宙飛船返回艙所用高溫結構陶瓷,屬于新型無機非金屬材料 組卷:11引用:1難度:0.7 -
2.某中德聯合研究小組設計制造了一種“水瓶”,用富勒烯(C60)的球形籠子作“瓶體”,一種磷酸鹽作“瓶蓋”,恰好可將一個水分子關在里面。下列說法正確的是( )
A.“水瓶”、冰水混合物、CuSO4?5H2O 都是混合物 B.金剛石、石墨和 C60互稱為同位素 C.磷酸鈣是難溶性弱電解質 D.一定條件下石墨轉化為C60是化學變化,屬于有單質參加的非氧化還原反應 組卷:105引用:7難度:0.6 -
3.設NA為阿伏加德羅常數的值。下列說法正確的是( )
A.25g46%的乙醇水溶液中含有的氫原子數為3NA B.將22.4L(標準狀況)Cl2通入足量水中,轉移的電子數為NA C.12gNaHSO4固體中含陽離子數目為0.2NA D.64gSO2和32gO2混合,反應一段時間后總原子數為4NA 組卷:85引用:3難度:0.5 -
4.下列表示對應化學反應的離子方程式正確的是( )
A.用過量氨水吸收工業尾氣中的SO2:NH3+SO2═NH4++HSO3- B.向NaClO溶液中加入少量SO2:2ClO-+SO2+H2O═2HClO+SO32- C.等物質的量的MgCl2、Ba(OH)2、HCl三種溶液混合:Mg2++4OH-+2H+═Mg(OH)2↓+2H2O D.0.01mol?L-1NH4Al(SO4)2溶液與0.02mol?L-1Ba(OH)2溶液等體積混合:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O 組卷:41引用:1難度:0.5 -
5.由重晶石礦 (主要成分是BaSO4,還含有SiO2等雜質)可制得氯化鋇晶體,某興趣小組設計實驗流程如圖。下列說法正確的是( )
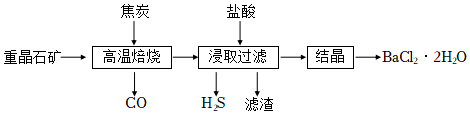
A.浸取過濾操作中得到的濾渣主要成分為SiO2 B.“高溫焙燒”和“結晶”兩處操作均需用到蒸發皿 C.在“高溫焙燒”焦炭和BaSO4的反應中,氧化劑與還原劑的物質的量之比為4:1 D.為提高產品產率,結晶得到的氯化鋇晶體常用乙醇進行洗滌 組卷:38引用:3難度:0.4 -
6.部分含N和含Cl物質的分類與相應化合價關系如圖所示。下列推斷不合理的是( )
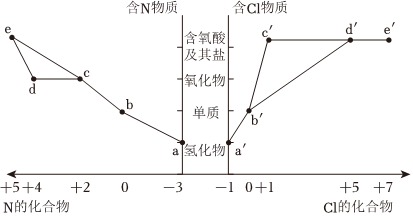
A.濃的a′溶液和濃的c′反應可以得到b′ B.工業上通過a→b→c→d→e來制備HNO3 C.d′的陰離子空間結構與其VSEPR模型不同 D.a與b′可發生氧化還原反應,氧化劑與還原劑物質的量之比為3:2 組卷:19引用:2難度:0.7
三、非選擇題:本題共4小題,共54分。
-
17.三氯氫硅(SiHCl3)是制備硅燒、多晶硅的重要原料。已知SiHCl3(g)在催化劑作用下發生反應:2SiHCl3(g)?SiH2Cl2(g)+SiCl4(g)。一定條件下,向容積為1L的恒容密閉容器中充入2molSiHCl3(g),分別在溫度為T1K、T2K條件下反應,測得反應體系中SiHCl3(g)的物質的量分數隨時間變化的關系如圖所示:

(1)在T1K溫度下,SiHCl3的平衡轉化率a(SiHCl3)=%。若想進一步提高SiHCl3的平衡轉化率,除改變溫度外還可以采取的措施是。
(2)下列不能判斷該反應達到平衡狀態的是(填標號)。
a.v正(SiHCl3)=2v逆(SiH2Cl2)
b.混合氣體的密度不再發生變化
c.SiHCl3與SiCl4的濃度之比不再改變
d.混合氣體的平均摩爾質量不再發生變化
(3)已知:反應速率v=v正-v逆=k正x2(SiHCl3)-k逆x(SiH2Cl2)?x(SiCl4),k正、k逆分別表示正、逆反應速率常數,x(B)為組分B的物質的量分數。
①a、b點的正反應速率之比va:vb(填“>”“<”或“=”)1。
②b點的=v正v逆(保留三位有效數字)。
(4)某種新型儲氫材料的晶胞如圖b,八面體中心為M金屬離子,頂點均為NH3配體;四面體中心為硼原子,頂點均為氫原子。若其摩爾質量為188g/mol,則M元素為(填元素符號);在該化合物中,M基態離子的價電子排布式為。 組卷:27引用:2難度:0.5
組卷:27引用:2難度:0.5 -
18.化合物G是防曬劑的有效成分,其合成路線如圖:
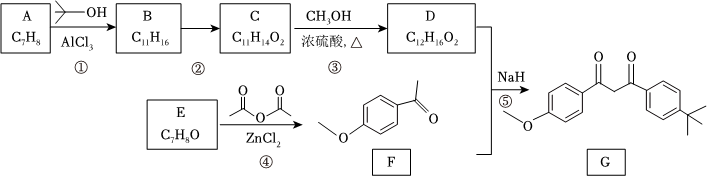
已知: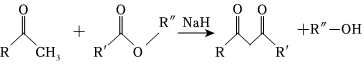
回答下列問題:
(1)A的化學名稱為,G中所含官能團的名稱為。
(2)反應①的反應類型為。
(3)D是酯類物質,物質C的結構簡式為。
(4)反應④的化學方程式為。
(5)芳香化合物X是F的同分異構體,X的結構只含一個環,核磁共振氫譜有四組峰,峰面積之比為6:2:1:1。X可能的結構有種,寫出兩種可與FeCl3溶液發生顯色反應的X的結構簡式。
(6)寫出以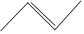 和
和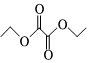 為原料制備化合物
為原料制備化合物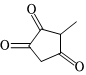 的合成路線 (其他無機試劑任選)。組卷:15引用:1難度:0.4
的合成路線 (其他無機試劑任選)。組卷:15引用:1難度:0.4


