2022-2023學年北京師大附屬實驗中學高三(上)期中化學試卷
發布:2024/4/20 14:35:0
一、選擇題本部分共14題,每題3分,共42分。在每題列出的四個選項中,選出最符合題目要求的一項。
-
1.宇航員在天宮實驗室進行水球實驗。下列有關水的說法不正確的是( )
A.H2O分子的共價鍵是s-sσ鍵 B.H2O分子之間可以形成氫鍵 C.H2O分子的空間構型是V字型 D.H2O分子內有極性共價鍵,H2O分子是極性分子 組卷:56引用:3難度:0.6 -
2.下列化學用語或圖示表達正確的是( )
A.二氧化碳電子式: 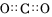
B.1,3-丁二烯結構簡式:CH2═CH2-CH2=CH2 C.乙醛空間結構模型: 
D.基態鐵原子價電子軌道表示式: 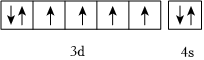 組卷:13引用:1難度:0.7
組卷:13引用:1難度:0.7 -
3.碘有多種同位素,其中127I是穩定同位素。下列說法不正確的是( )
A.碘元素位于第六周期ⅦA族 B.碘原子序數為53,是非金屬元素 C.可用質譜法區分131I和127I D.I2易溶于乙醚、乙醇等有機溶劑 組卷:24引用:1難度:0.8 -
4.下列化學用語對事實的表述不正確的是( )
A.工業上用乙醛催化氧化法制乙酸:2CH3CHO+O2 2CH3COOH催化劑△B.苯酚鈉溶液中通入少量二氧化碳:2C6H5O-+CO2+H2O→2C6H5OH+CO32- C.用Na2S除去工業廢水中的Hg2+:Hg2++S2-═HgS↓ D.用明礬凈水:Al3++3H2O?Al(OH)3(膠體)+3H+ 組卷:19引用:2難度:0.6 -
5.為探究電解過程中的放電規律,某研究小組進行下列實驗:
下列說法不正確的是( )序號 陽極材料 陰極材料 電解質 陽極產物 陰極產物 ① 石墨 石墨 熔融NaCl Cl2 Na ② 石墨 石墨 0.1mol?L-1NaCl溶液 Cl2 H2 ③ 石墨 石墨 0.2mol?L-1CuSO4溶液 O2 Cu ④ 銅 石墨 0.2mol?L-1CuSO4溶液 Cu2+ Cu ⑤ 石墨 石墨 0.1mol?L-1CuCl2溶液 Cl2 Cu A.對比②⑤可知,陰極放電順序是:Cu2+>H+>Na+ B.對比③⑤可知,陽極放電順序是:Cl->OH->SO42- C.對比③④可知,陽極是銅時,會先于溶液中的離子放電 D.對比①⑤可知,電解得到金屬只能用熔融態,不能用水溶液 組卷:65引用:1難度:0.5 -
6.下列物質混合后,因發生氧化還原反應使溶液pH增大的是( )
A.向稀硝酸銀溶液中通入少量氨氣產生棕黑色沉淀 B.向亞硫酸鈉溶液中加入少量次氯酸鈉溶液無明顯現象 C.酸性碘化鉀溶液放置在空氣中變為棕黃色 D.向硫酸亞鐵溶液中加入少量過氧化鈉粉末產生紅褐色沉淀,且未見氣體生成 組卷:6引用:1難度:0.6
二、非選擇題第二部分本部分共5題,共58分。
-
18.鍶(Sr)是第五周期ⅡA族元素。自然界中的鍶存在于天青石中,天青石的主要成分為SrSO4和少量CaSO4、BaSO4。以天青石為原料制備高純SrCO3需要兩個步驟。
【步驟一】從天青石到粗SrCO3: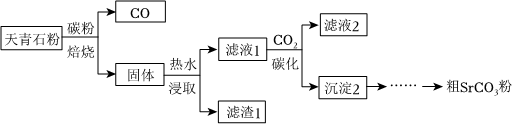
已知:ⅰ.Ca、Sr、Ba硫化物(MS)和硫氫化物[M(HS)2]均易溶于水。
ⅱ.20℃時,Sr(OH)2、Ba(OH)2、Ca(OH)2的溶解度(g)分別為1.77、3.89、0.173;80℃時,Sr(OH)2、Ba(OH)2、Ca(OH)2的溶解度(g)分別為20.2、101.4、0.094。
(1)焙燒過程中SrSO4轉化為SrS的化學方程式是。
(2)浸取時發生反應:2MS+2H2O?M(HS)2+M(OH)2(M=Ca、Sr、Ba)。使用熱水有利于提高SrS的平衡轉化率,原因是。
(3)濾渣1的主要成分是。
【步驟二】粗SrCO3轉化為高純SrCO3:
(4)粗SrCO3中的雜質是BaCO3。有同學提出可以將粗SrCO3產物溶于酸,再加入Na2SO4溶液實現Sr和Ba的分離。設Ba2+完全沉淀時c(Ba2+)=10-5mol/L,則溶液中c(Sr2+)一定不大于mol/L。此時會有Sr2+沉淀,該方案不合理。[Ksp(BaSO4)=1.1×10-10,Ksp(SrSO4)=3.3×10-7]
(5)實際的除雜和轉化流程如圖所示: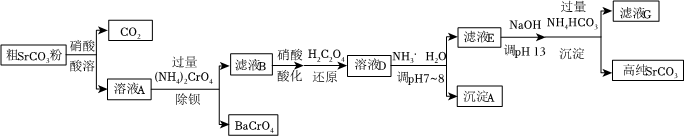
已知:ⅰ.溶液中存在Cr2+H2O?2O2-7+2H+,Cr2CrO2-4具有強氧化性。O2-7
ⅱ.Cr(OH)3是兩性氫氧化物,難溶于水,Ksp[Cr(OH)3]=1×10-31。
①若酸溶過程中H+過量太多,則除鋇過程中Ba2+去除率會下降,請從化學平衡移動角度解釋原因。
②還原過程中草酸(H2C2O4)發生反應的離子方程式為。
③為除鉻,向溶液D中加入NH3?H2O調節pH為7~8。此過程不調節pH為13的原因是。
④加入NH4HCO3溶液生成高純SrCO3的離子方程式為。組卷:18引用:1難度:0.5 -
19.某小組同學利用隔絕空氣的密閉容器對稀硝酸和金屬的反應進行了研究。
實驗Ⅰ的操作及現象是:
ⅰ.室溫下,在反應器中加入過量的鐵粉與2mL0.5mol/LHNO3,有氣體生成,溶液呈淺綠色,反應結束后收集到無色氣體6.0mL。
ⅱ.將收集到氣體通入有空氣的容器中,無明顯變化:然后點燃氣體,有尖銳的爆鳴聲,并產生無色液滴。
ⅲ.取ⅰ中反應后溶液,加入足量NaOH溶液并加熱,立刻得到白色沉淀,迅速變為灰綠色;加熱后產生能使濕潤紅色石蕊試紙變藍的氣體。
(1)氣體產物中含有H2的實驗證據是。經進一步檢驗氣體產物中只有H2。
(2)反應中,硝酸還有其他還原產物,生成該還原產物的離子方程式是。
(3)對產生H2的原因提出假設并進行了研究:
①假設1:該濃度的硝酸中H+的氧化性大于NO3-;經實驗檢驗,假設1不成立。實驗方案是,實驗證據是。
②假設2:(補出合理假設)。同學們用其他實驗方案,驗證該假設成立。
(4)僅改變實驗溫度,重復實驗Ⅰ。實驗中得到的氣體和溶液的成分與實驗Ⅰ相同,但收集到的氣體體積不同:反應溫度為40℃時,氣體體積為3.4mL;反應溫度為60℃時,氣體體積為2.6mL。對實驗現象給出合理解釋:。
(5)實驗Ⅱ:
根據前面實驗得出的結論,解釋本實驗中生成該還原產物的原因:實驗 現象 室溫下,在反應器中加入過量的鐵粉與2mL3MOL/HNO3 有無色氣體生成,經檢驗不含可燃性氣體;氣體接觸空氣顯紅棕色;溶液變為深棕色 。
(6)綜上所述,金屬與硝酸生成氫氣需要控制的條件是。組卷:11引用:1難度:0.7


