2022年云南省昭通市正道高級完全中學中考化學模擬試卷(二)
發布:2024/4/20 14:35:0
一、選擇題(本大題共20個小題,第1—15小題,每小題2分,第16—20小題,每小題2分,共45分。每小題只有一個選項,符合題意,多選、錯選或不選均不得分)
-
1.下列詩句描述的景象中,沒有涉及化學變化的是( )
A.千錘萬鑿出深山 B.烈火焚燒若等閑 C.粉身碎骨渾不怕 D.要留清白在人間 組卷:40引用:5難度:0.6 -
2.空氣成分中含量較多且化學性質活潑的氣體是( )
A.氮氣 B.氧氣 C.二氧化碳 D.稀有氣體 組卷:31引用:7難度:0.9 -
3.下列說法不正確的是( )
A.食鹽不是鹽 B.純堿不是堿 C.水銀不是銀 D.干冰不是冰 組卷:12引用:3難度:0.9 -
4.實驗操作錯誤的是( )
A. 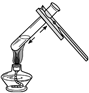
加熱液體B. 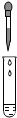
滴加液體C. 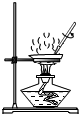
加熱蒸發D. 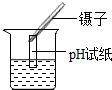
測定溶液pH組卷:137引用:5難度:0.9 -
5.云南有一怪,米做的粑粑叫餌塊,其含有的營養物質是( )
A.蛋白質 B.維生素 C.油脂 D.糖類 組卷:10引用:2難度:0.7 -
6.下列物質能形成溶液的是( )
A.泥土 B.菜籽油 C.食鹽 D.面粉 組卷:62引用:3難度:0.8 -
7.下列物質屬于合成材料的是( )
A.棉花 B.蠶絲 C.塑料 D.羊毛 組卷:31引用:32難度:0.9 -
8.入芝蘭之室可聞其香因為( )
A.分子間有間隔 B.分子的體積很小 C.分子在運動 D.分子會變大 組卷:68引用:2難度:0.6 -
9.氮化鈉的化學式Na3N,其中氮元素的化合價為( )
A.-2 B.-3 C.+1 D.+3 組卷:158引用:4難度:0.4
三、實驗與探究(本大題共2個小題,化學方程式每空2分,其余每空1分,共16分)
-
27.氫化鈣(CaH2)固體與水反應制取氫氣,反應的方程式為CaH2+2H2O═Ca(OH)2+2H2↑,實驗室中某同學把一定量的CaH2加入Na2CO3溶液中,充分反應后過濾,得到濾渣和濾液,并對濾液的成分進行探究。
【提出問題】濾液中溶質的成分是什么?
【猜想與假設】猜想一:NaOH
猜想二:NaOH、Ca(OH)2
猜想三:NaOH、Na2CO3
猜想四:NaOH、Na2CO3、Ca(OH)2
其中猜想不合理。
【設計實驗】
寫出實驗二中產生氣泡的化學方程式:實驗 實驗操作 實驗現象 實驗結論 實驗— 取少量濾液于試管中,向試管這滴入適量的碳酸鈉溶液 猜想二不成立 實驗二 另取少量濾液于試管中,向其中加入過量稀鹽酸 產生氣泡 猜想 成立。
【拓展延伸】
下列說法不正確的是(填序號)。
①若向CuSO4溶液中加少量CaH2,充分反應,產生的現象是有氣泡產生、藍色沉淀
②保存CaH2密封、防潮
③氫化鈣CaH2是很好貯氫劑,便于運輸、攜帶
④向FeCl3溶液中加少量CaH2,充分反應,產生的現象只有氣泡產生組卷:13引用:1難度:0.6
四、分析與計算(本大題共1個小題,共6分)
-
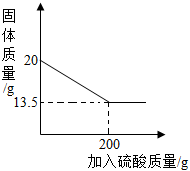 28.黃銅是銅鋅合金,取20g樣品與硫酸反應,固體質量和加入硫酸的質量變化如圖,請計算:
28.黃銅是銅鋅合金,取20g樣品與硫酸反應,固體質量和加入硫酸的質量變化如圖,請計算:
(1)樣品中鋅的質量g。
(2)求硫酸溶液中溶質質量分數。(寫出計算過程,結果保留到小數點后第一位)組卷:16引用:2難度:0.5


