2021-2022學年安徽省淮北市樹人高級中學高二(上)第一次月考化學試卷
發布:2024/4/20 14:35:0
一、選擇題(每小題只有一個選項符合題意。每題3分,共54分)
-
1.被稱為人體冷凍學之父的羅伯特?埃廷格(Robert Ettinger)在1962年寫出《不朽的前景》(The Prospect Of Immortality)一書。他在書中列舉了大量事實,證明了冷凍復活的可能。比如,許多昆蟲和低等生物冬天都凍僵起來,春天又自動復活。下列結論中與上述信息相關的是( )
A.溫度降低,化學反應停止 B.催化劑加快化學反應速率 C.溫度越低,化學反應越慢 D.低溫下分子無法運動 組卷:26引用:3難度:0.7 -
2.2019年12月以來,我國武漢等地相繼暴發了新冠肺炎,為此我國政府和相關部門采取了多項措施控制疫情。75%乙醇和84消毒液等均能有效滅活新冠病毒。84消毒液的主要成分是次氯酸鈉。設NA為阿伏加德羅常數的值,下列說法正確的是( )
A.74.5g次氯酸鈉中含有的離子數目為2NA B.1mol次氯酸鈉與足量鹽酸反應轉移的電子數為2NA C.46g乙醇中含有極性鍵數目為6NA D.利用氯氣和氫氧化鈉溶液反應制取0.1mol次氯酸鈉需要消耗2.24L氯氣 組卷:24引用:2難度:0.5 -
3.下列事實不能用平衡移動原理解釋的是( )
A.濃硫酸的使用有利于酯化反應 B.夏天打開啤酒瓶,有許多氣泡冒出 C.Fe(SCN)3溶液中加入6mol/L NaOH溶液后顏色變淺 D.唾液可以使淀粉水解速率加快 組卷:10引用:1難度:0.7 -
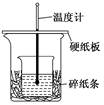 4.某實驗小組學生用50mL 0.50 mol/L的鹽酸與50 mL 0.55 mol/L的NaOH溶液在如圖所示的裝置中進行中和反應。通過測定反應過程中所放出的熱量計算反應熱。下列說法不正確的是( )
4.某實驗小組學生用50mL 0.50 mol/L的鹽酸與50 mL 0.55 mol/L的NaOH溶液在如圖所示的裝置中進行中和反應。通過測定反應過程中所放出的熱量計算反應熱。下列說法不正確的是( )A.若改用60 mL 0.50 mol/L鹽酸跟50 mL 0.55 mol/L的NaOH溶液進行反應,從理論上說所求反應熱不變 B.圖中實驗裝置缺少環形玻璃攪拌棒 C.燒杯間填滿碎紙條的作用是防止熱量損失,減少實驗誤差 D.如圖條件下實驗過程中沒有熱量損失 組卷:45引用:5難度:0.7 -
5.如圖為氟利昂(如CFCl3)破壞臭氧層的反應過程示意圖,下列說法不正確的是( )
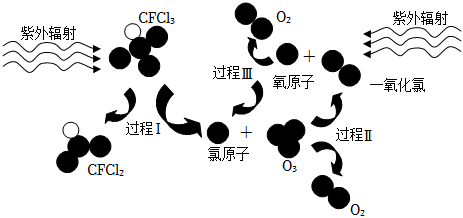
A.過程Ⅰ中斷裂極性鍵C-Cl鍵 B.過程Ⅱ可表示為O3+Cl=ClO+O2 C.過程Ⅲ中O+O=O2是吸熱過程 D.上述過程說明氟利昂中氯原子是破壞O3的催化劑 組卷:196引用:36難度:0.7 -
6.已知反應:2NO(g)+Br2(g)?2NOBr(g)△H═-akJ?mol-1(a>0),其反應機理如下:
①NO(g)+Br2(g)?NOBr2(g)快
②NO(g)+NOBr2(g)?2NOBr(g)慢
下列有關該反應的說法正確的是( )A.該反應的速率主要取決于①的快慢 B.NOBr2是該反應的催化劑 C.慢反應②的活化能小于快反應的活化能 D.正反應的活化能比逆反應的活化能小akJ?mol-1 組卷:56引用:5難度:0.6 -
7.某溫度下2L密閉容器中,3種氣體起始狀態和平衡狀態時的物質的量(n)如下表所示.下列說法正確的是( )
X Y W n(起始狀態)/mol 2 1 0 n(平衡狀態)/mol 1 0.5 1.5 A.該溫度下,此反應的平衡常數K=6.75 B.升高溫度,若W的體積分數減小,則此反應△H>0 C.增大壓強,正、逆反應速率均增大,平衡向正反應方向移動 D.該溫度下,此反應的平衡常數表達式是K= c2(X)?c(Y)c3(W)組卷:350引用:7難度:0.7
二、非選擇題(本大題共48分)
-
21.甲苯(C7H8)和二甲苯(C8H10)是重要的化工原料。利用苯(C6H6)和甲醇(CH3OH)在催化劑作用下反應得到C7H8、C8H10和副產物三甲苯(C9H12),發生的主要反應如下:
Ⅰ.C6H6(g)+CH3OH(g)?C7H8(g)+H2O(g)
Ⅱ.C7H8(g)+CH3OH(g)?C8H10(g)+H2O(g)
Ⅲ.C8H10(g)+CH3OH(g)?C9H12(g)+H2O(g)
(1)500℃、0.18Mpa條件下,反應達到平衡時,結果如圖所示。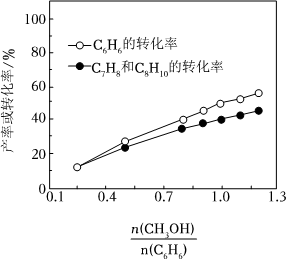
①由圖分析,隨著投料比增加,CH3OH的平衡轉化率n(CH3OH)n(C6H6),平衡時的值n(C9H12)n(C7H8)+n(C8H10)+n(C9H12)。(填“增大”、“減小”或“不變”)。
②投料比為1.0時,C6H6的平衡轉化率為50%,產物中C7H8、C8H10和C9H12物質的量之比為6:3:1.CH3OH的平衡轉化率為n(CH3OH)n(C6H6),反應Ⅰ的平衡常數K═。
(2)我國學者結合實驗與計算機模擬結果,研究了反應Ⅰ在固體酸(HB)催化劑表面進行的反應歷程如圖所示。其中吸附在固體酸(HB)表面的物種用*標注。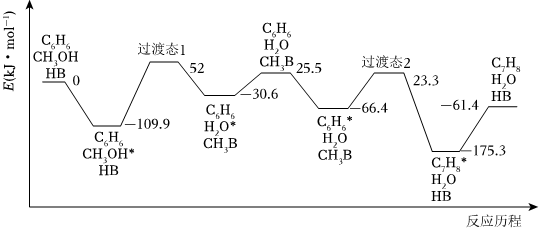
①反應Ⅰ的△H═kJ?mol-1。
②吸附CH3OH的焓變吸附C6H6的焓變(填“>”或“<”)。
③C6H6*在催化劑表面轉化為C7H8*的反應方程式為。
④在固體酸(HB)催化作用下,測得反應I的速率方程為v═k?p(C6H6)(k為速率常數)。在剛性容器中發生反應Ⅰ,關于反應Ⅰ的平衡常數(K)和反應速率(v)的敘述正確的是(填標號)。
A.升高溫度,K和v均增大
B.增大p(C6H6),K不變,v增大
C.降低溫度,K和v均減小
D.增大p(CH3OH),K不變,v增大組卷:51引用:3難度:0.5 -
22.氨基甲酸銨(H2NCOONH4)是化學工業中尿素生產過程的中間產物,加熱脫水形成尿素;氨基甲酸銨為有毒物品;可燃,燃燒放出有毒氮氧化物和氨氣。某化學興趣小組用圖1所示裝置制取氨基甲酸銨。
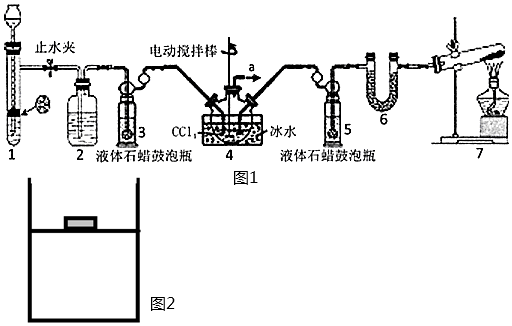
已知:①制取氨基甲酸銨反應為:2NH3(g)+CO2(g)?H2NCOONH4(s)△H<0。
②氨基甲酸銨易分解、易吸水,溶于水后生成碳酸氫銨和一水合氨。
回答下列問題:
(1)裝置3和5的作用是。
(2)裝置6中的試劑是(從下面選項中選擇,下同),導管a出口直接與尾氣處理裝置連接,該尾氣處理裝置中的試劑是。
A.稀硫酸
B.濃硫酸
C.堿石灰
D.氫氧化鈉溶液
(3)寫出氨基甲酸銨水解的化學方程式為。
(4)三頸燒瓶需用冰水浴冷卻,其目的是。
(5)某校化學興趣研究小組把氨氣和二氧化碳按體積比2:1通入如圖2所示體積可變的裝置中,在常溫常壓下進行實驗:當反應達到平衡后,陳同學通過用手按壓活塞增大壓強來提高轉化率,起初裝置內壓強增大,溫度升高,過一段時間后裝置又恢復到初始溫度,請問:此時陳同學如果松開手,活塞(填“是”或“否”)回彈?原因:。組卷:12引用:1難度:0.6


