2021-2022學(xué)年寧夏銀川二中高二(下)期中化學(xué)試卷
發(fā)布:2024/4/20 14:35:0
一、單選題(每題2分,共42分,每題只有一個(gè)選項(xiàng)符合題意)
-
1.為了應(yīng)對(duì)能源危機(jī),當(dāng)今世界正在積極開發(fā)利用新能源,下列不屬于新能源的是( )
A.生物質(zhì)能 B.石油 C.氫能 D.核能 組卷:10引用:1難度:0.8 -
2.有一支50mL酸式滴定管中盛鹽酸,液面恰好在10mL刻度處,把管內(nèi)液體全部放出,盛入量筒內(nèi),所得液體體積是( )
A.10mL B.40mL C.大于10mL D.大于40mL 組卷:1引用:1難度:0.7 -
3.下列說(shuō)法正確的是( )
A.常溫下,水的電離常數(shù)為1×10-14 B.焊接時(shí)用NH4Cl溶液除銹 C.向AgCl飽和溶液中加水,可增大AgCl的溶解度 D.難溶電解質(zhì)可以轉(zhuǎn)化為更難溶的電解質(zhì),更難溶電解質(zhì)不能轉(zhuǎn)化為難溶電解質(zhì) 組卷:1引用:1難度:0.6 -
4.我國(guó)科學(xué)家使用雙功能催化劑催化水煤氣變換反應(yīng):CO(g)+H2O(g)═CO2(g)+H2(g)ΔH<0,在低溫下獲得高轉(zhuǎn)化率與高反應(yīng)速率,反應(yīng)過(guò)程示意圖如圖,下列說(shuō)法正確的是( )
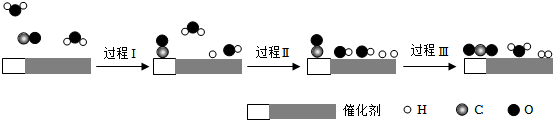
A.過(guò)程Ⅰ、過(guò)程Ⅱ均為放熱過(guò)程 B.圖中顯示:起始時(shí)的2個(gè)H2O都參與了反應(yīng)過(guò)程 C.過(guò)程Ⅲ只生成了極性共價(jià)鍵 D.使用催化劑降低了水煤氣變換反應(yīng)的ΔH 組卷:27引用:2難度:0.7 -
5.一定條件下,體積為10L的密閉容器中充入1molX和1molY進(jìn)行反應(yīng):2X(g)+Y(g)?Z(g),60s后反應(yīng)達(dá)到平衡,生成0.3molZ。下列說(shuō)法正確的是( )
A.X的平衡轉(zhuǎn)化率為40% B.若將容器體積變?yōu)?0L,則Z的平衡濃度小于原來(lái)的 12C.若增大壓強(qiáng),則Y的平衡轉(zhuǎn)化率減小 D.若升高溫度,X的體積分?jǐn)?shù)增大,則該反應(yīng)的ΔH>0 組卷:21引用:1難度:0.9 -
6.關(guān)于下列圖象說(shuō)法正確的是( )
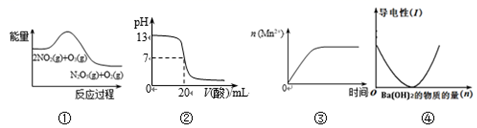
A.①表示化學(xué)反應(yīng)2NO2(g)+O3(g)=N2O5(g)+O2(g) ΔH>0 B.②表示25℃時(shí),用0.1mol/LCH3COOH溶液滴定20mL0.1mol/LNaOH溶液,溶液的pH隨加入酸體積的變化 C.③表示10mL0.01mol/L酸性KMnO4溶液與過(guò)量的0.1mol/LH2C2O4溶液混合時(shí),n(Mn2+)隨時(shí)間的變化 D.④可表示向稀硫酸溶液中滴加氫氧化鋇溶液,溶液導(dǎo)電性隨氫氧化鋇物質(zhì)的量的變化 組卷:1引用:1難度:0.6 -
7.下列關(guān)于電解質(zhì)溶液說(shuō)法錯(cuò)誤的是( )
A.室溫下,pH=11的NaOH溶液和pH=3的CH3COOH溶液,水的電離程度相同 B.向0.1mol/LCH3COOH溶液中加入少量水,溶液中的所有離子的濃度都減小 C.pH=2的H2C2O4和pH=12的NaOH溶液以任意比例混合:c(Na+)+c(H+)=c(OH-)+c(HC2 )+2c(C2O-4)O2-4D.pH相同的a.CH3COONa溶液、b.NaHCO3溶液、c.NaClO溶液的溶液中c(Na+)的大小順序是a>b>c 組卷:3引用:1難度:0.7 -
8.將CaCO3放入密閉的真空容器中,反應(yīng):CaCO3 (s)?CaO(s)+CO2(g)達(dá)到平衡。保持溫度不變,縮小容器容積,體系重新達(dá)到平衡,下列說(shuō)法正確的是( )
A.平衡常數(shù)減小 B.CaO物質(zhì)的量不變 C.CO2濃度不變 D.CO2濃度變大 組卷:7引用:2難度:0.5
二、填空題
-
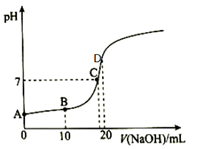 24.25℃向20mL0.1mol/LCH3COOH溶液中滴入0.1mol/LNaOH溶液過(guò)程中,pH變化如圖所示。
24.25℃向20mL0.1mol/LCH3COOH溶液中滴入0.1mol/LNaOH溶液過(guò)程中,pH變化如圖所示。
(1)A點(diǎn)溶液pH1(填“>”、“<”或“=”),用化學(xué)用語(yǔ)解釋原因:。
(2)B點(diǎn)溶液的溶質(zhì)為,其中c(Na+)、c(CH3COOH)、c(CH3COO-)滿足的等式關(guān)系為,這三種微粒濃度由大到小的順序?yàn)?。
(3)A、C兩點(diǎn)水的電離程度:AC(填“>”、“<”或“=”)。
(4)D點(diǎn)溶液中離子濃度由大到小的順序?yàn)椋?!--BA-->。組卷:2引用:1難度:0.5 -
25.某礦渣富含MgO、B2O3及少量SiO2、Al2O3、FeO雜質(zhì)。由該礦渣濕法制備硫酸鎂晶體和硼酸晶體的一種工藝流程如圖:
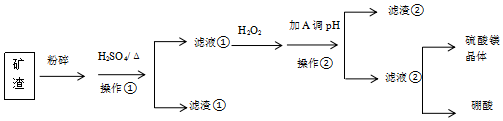
已知:生成氫氧化物沉淀的pH(金屬離子的起始濃度為0.1mol/L)
回答下列問(wèn)題Fe(OH)3 Al(OH)3 Fe(OH)2 Mg(OH)2 開始沉淀時(shí) 1.9 3.4 7.0 9.1 沉淀完全時(shí) 3.2 4.7 9.0 11.1
(1)礦渣為何要粉碎。
(2)操作 ①的名稱為。
(3)濾渣①的主要成分為。
(4)濾液 ①中加入H2O2的目的為。
(5)用(填A(yù)的化學(xué)式)調(diào)節(jié)溶液的pH范圍為,使雜質(zhì)離子轉(zhuǎn)化為(填化學(xué)式)沉淀,過(guò)濾。
(6)獲取晶體
ⅰ.濃縮濾液,使MgSO4和H3BO3接近飽和;
ⅱ.控制溫度使兩種晶體分別從溶液中結(jié)晶。
結(jié)合如圖溶解度曲線,簡(jiǎn)述ⅱ的方法:將濃縮液加入到高壓釜(高壓環(huán)境可保證在高溫條件下水為液態(tài))中,(將方法補(bǔ)充完整)。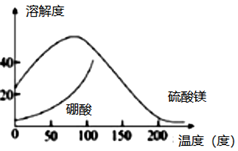
(7)已知硼酸與過(guò)量NaOH溶液發(fā)生的中和反應(yīng)為:H3BO3+OH-=B(OH)4-,硼酸為元酸。組卷:5引用:1難度:0.5


