2022-2023學年黑龍江省哈爾濱三中高三(上)期中化學試卷
發布:2024/12/3 22:30:2
一、選擇題(本題包括20小題,每小題只有一個選項符合題意,每小題3分,共60分)
-
1.下列事實不能用勒夏特列原理解釋的是( )
A.新制的氯水在光照條件下顏色變淺 B.H2和I2生成HI的反應達平衡后加壓,顏色變深 C.實驗室用排飽和食鹽水的方法收集氯氣 D.工業生產硫酸的過程中使用過量的空氣以提高SO2的利用率 組卷:16引用:1難度:0.6 -
2.下列說法正確的是( )
A.目前人類直接利用的能源都來源于太陽能 B.合成氨工業中采用高溫以提高平衡轉化率 C.反應NH3(g)+HCl(g)═NH4Cl(s)在室溫下可自發進行,則該反應的ΔH<0 D.選擇不同的催化劑會改變反應△H的數值 組卷:7引用:1難度:0.7 -
3.下列各組物質中,不滿足組內任意兩種物質在一定條件下均能發生反應的是( )
甲 乙 丙 A NH3 O2 HNO3 B Al(OH)3 HCl NaOH C SiO2 NaOH HF D SO2 Ca(OH)2 NaHCO3 A.A B.B C.C D.D 組卷:20引用:1難度:0.7 -
4.以NA表示阿伏加德羅常數的值。下列敘述中正確的是( )
A.常溫常壓下,11.2L的甲烷氣體含有分子數為0.5NA B.14g乙烯和環丙烷的混合物中總原子數為3NA C.0.2mol/L的氫氧化鈉溶液中含鈉離子數為0.2NA D.5.6g鐵與足量的稀硫酸反應失去電子數為0.3NA 組卷:5引用:1難度:0.6 -
5.將一定量純凈的氨基甲酸銨固體置于密閉真空容器中(假設容器體積不變,固體試樣體積忽略不計),在恒定溫度下使其達到分解平衡H2NCOONH4(s)?2NH3(g)+CO2(g)。能判斷該反應已經達到化學平衡的是( )
①2v正(NH3)=v逆(CO2)
②密閉容器中氨氣的物質的量濃度不變
③密閉容器中混合氣體的密度不變
④混合氣體的平均相對分子質量不變
⑤密閉容器混合氣體的總物質的量不變
⑥形成6molN-H鍵同時消耗44gCO2A.②③⑤⑥ B.①②⑤⑥ C.①③⑤⑥ D.全部 組卷:56引用:3難度:0.7 -
6.合成氨工業中氫氣可由天然氣和水反應制備,其主要反應為:CH4(g)+2H2O(g)?CO2(g)+4H2(g)。已知下列鍵能數據:
則該反應的反應熱△H為( )化學鍵 C-H H-O C=O H-H 鍵能/kJ?mol-1 414 464 803 436 A.-162kJ/mol B.+162kJ/mol C.+965kJ/mol D.+1470kJ/mol 組卷:10引用:1難度:0.8 -
7.向一容積固定的容器中充入2molSO3(g)發生反應:2SO3(g)?2SO2(g)+O2(g)ΔH>0。達到平衡后,保持溫度不變,繼續向該容器中充入1molSO3(g)則達到新平衡時SO3(g)的體積分數將( )
A.變大 B.變小 C.不變 D.無法判斷 組卷:80引用:2難度:0.9
二、填空題(本題包括3個小題,共40分)
-
22.海洋的水資源和其他化學資源具有十分巨大的開發潛力。
(1)“氯堿工業”電解飽和食鹽水的化學方程式為:。制取的氯氣是實驗室和工業上的常用氣體,科學家基于Cl2易溶于CCl4的性質,發展了一種無需離子交換膜的新型氯流電池,可作儲能設備(如圖1)。充電時,電極a的反應為:NaTi2(PO4)3+2Na++2e-═Na3Ti2(PO4)3。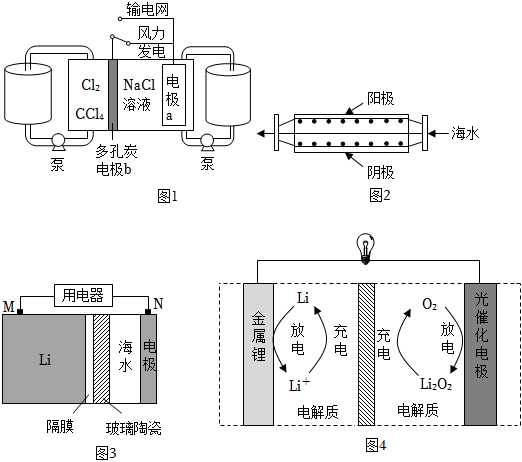
①放電時:正極反應式為,NaCl溶液的濃度。
②充電時:電極b是極;每生成1molCl2,電極a質量理論上增加g。
(2)沿海電廠采用海水為冷卻水,但在排水管中生物的附著和滋生會阻礙冷卻水排放并降低冷卻效率,為解決這一問題,通常在管道口設置一對惰性電極(如圖2所示),通入一定的電流。陰極①陰極的電極反應式為:,會使海水中的Mg2+沉淀積垢,需定期清理。②陽極區生成的Cl2在管道中可以生成氧化滅殺附著生物的NaClO的離子方程式為:。
(3)海水電池在海洋能源領域備受關注,一種鋰-海水一次電池構造示意圖如圖3(玻璃陶瓷具有傳導離子和防水的功能)。
①M電極發生(填反應類型)。
②N電極反應為2H2O+2e-═2OH-+H2↑和。
(4)近年來科學家研究了一種光照充電Li-O2電池(如圖5所示)。光照時,光催化電極產生電子(e-和空穴(h+),驅動陰極反應(Li++e-═Li)和陽極反應(Li2O2+2h+═2Li++O2)對電池進行充電。放電時,Li+從電極穿過離子交換膜向電極遷移,總反應為:。組卷:21引用:1難度:0.5 -
23.工業合成氨是人類科學技術的一項重大突破,目前已有三位科學家因其獲得諾貝爾獎,反應為:N2(g)+3H2(g)?2NH3(g)ΔH=-92.4kJ?mol-1 ΔS=-200J?K-1?mol-1。請回答下列問題:
(1)常溫下,合成氨反應(填“能”或“不能”)自發進行,其平衡常數表達式K=。
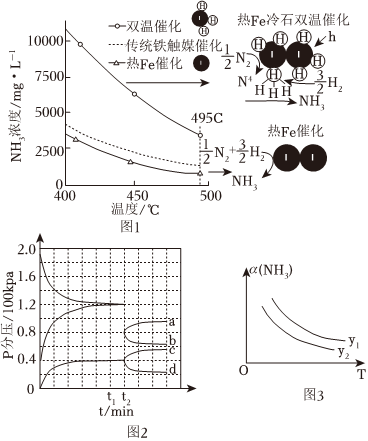
(2)溫度(填“高”或“低”)有利于提高反應速率,溫度(填“高”或“低”)有利于提高平衡轉化率,綜合考慮催化劑(鐵觸媒)活性等因素,工業常采用400~500℃。
(3)針對反應速率與平衡產率的矛盾,我國科學家提出了解決方案:雙溫-雙控-雙催化劑。使用Fe-TiO2-xHy雙催化劑,通過光輻射產生溫差(如體系溫度為495℃時,Fe的溫度為547℃,而TiO2-xHy的溫度為415℃)。該方案的優勢:①;②。
(4)一定溫度和催化劑的條件下,將0.1molNH3通入3L的密閉容器中進行NH3分解為N2和H2的反應(此時容器內總壓為200kPa),各物質的分壓隨時間的變化曲線如圖2所示。
①若保持容器體積不變,t1時反應達到平衡,用H2的濃度變化表示0~t1時間內的反應速率v(H2)=mol?L-1?min-1。(用含t1的代數式表示)
②t2時將容器體積迅速縮小至原來的一半并保持不變,圖中能正確表示壓縮后N2分壓變化趨勢的曲線是(用圖中a、b、c、d表示)。
(5)合成尿素的反應為:2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g)ΔH。
①其他條件相同,在不同溫度(T)及不同壓強(y)值下合成尿素,達到平衡時,氨氣轉化率的變化情況如圖3所示,則ΔH(填“>”“<”或“=”,下同)0,y1y2。
②T℃、2L的恒容密閉容器,加入3molNH3和1molCO2,達平衡時壓強為開始時的,其平衡常數K=34。若保持條件不變,再向該容器中加入0.5molCO2和1molH2O(g),NH3的平衡轉化率將(填“增大”“減小”或“不變”)。組卷:16引用:1難度:0.3


