2023-2024學年浙江省紹興市城東中學九年級(上)段考科學試卷(9月份)
發布:2024/9/2 2:0:8
一.選擇題(每題3分,共60分)
-
1.中華文明源遠流長,在我國古代的技術應用中,其工作原理涉及化學變化的是( )
A. 
水車灌溉B. 
棉線織布C.  活字印刷
活字印刷D. 
燒制陶瓷組卷:58引用:2難度:0.5 -
2.如圖是常見物質的pH值,下列說法不正確的是( )

A.蘋果汁顯酸性 B.廁所清潔劑與爐具清潔劑混合后使用效果更佳 C.蘇打水可以中和部分胃酸 D.人被某些蚊蟲叮咬后可涂抹肥皂水,以減輕蚊蟲分泌的酸性物質引起的痛癢 組卷:40引用:5難度:0.5 -
3.下列物質暴露在空氣中,質量會減少的是( )
A.氫氧化鈉固體 B.濃硫酸 C.濃鹽酸 D.氯化鈉固體 組卷:14引用:1難度:0.5 -
4.用括號內的物質不能區分的一組是( )
A.NaCl、NaOH、CaCO3三種固體 (水) B.K2CO3、Na2SO4、BaCl2三種溶液 (稀硫酸) C.鐵粉、碳粉、氧化銅粉末 (稀鹽酸) D.NaOH、NaCl、Na2SO4三種溶液 (酚酞) 組卷:88引用:3難度:0.5 -
5.物質X、Y之間存在如下關系:X+2NaOH═2Y+Cu(OH)2↓,則( )
A.X一定是Cu(NO3)2 B.X的式量比Y大 C.Y中陰離子的化合價為-2 D.該反應類型為化合反應 組卷:8引用:1難度:0.5 -
6.若人長期吃菠菜炒豆腐易得結石病,因為菠菜里的草酸(H2C2O4)和豆腐中的硫酸鈣會反應生成難溶于水的草酸鈣,其化學方程式為:H2C2O4+CaSO4═CaC2O4↓+H2SO4,該反應屬于( )
A.分解反應 B.化合反應 C.置換反應 D.復分解反應 組卷:13引用:5難度:0.5 -
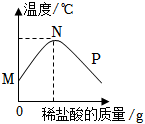 7.一定溫度下,向含有適量酚酞溶液的氫氧化鈉溶液中慢慢滴加稀鹽酸,溶液溫度隨加入稀鹽酸的質量如圖所示。下列敘述不正確的是( )
7.一定溫度下,向含有適量酚酞溶液的氫氧化鈉溶液中慢慢滴加稀鹽酸,溶液溫度隨加入稀鹽酸的質量如圖所示。下列敘述不正確的是( )A.N點時溶液的pH最小 B.N點表示氫氧化鈉與稀鹽酸恰好完全反應 C.P點時溶液呈無色 D.P點時,溶液中除酚酞外還含有兩種溶質 組卷:7引用:2難度:0.5 -
8.下列四組實驗中,不能體現酸的通性的是( )
A. 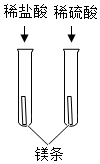
B. 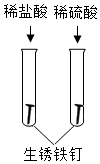
C. 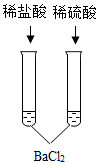
D. 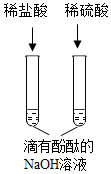 組卷:47引用:7難度:0.5
組卷:47引用:7難度:0.5 -
9.下列關于Ca(OH)2的說法,錯誤的是( )
A.微溶于水,水溶液呈堿性,能使無色酚酞變紅 B.能與酸反應,可用于降低土壤的酸性 C.可與CuSO4溶液按一定比例混合配制波爾多液,該反應屬于復分解反應 D.其澄清溶液可用來檢驗CO2,與CO2反應后溶液質量增加 組卷:34引用:9難度:0.5 -
10.如圖所示,圍棋棋盤上有五枚棋子,代表鐵、稀鹽酸、氫氧化鋇、碳酸鈣、硝酸銀五種物質,相鄰棋子間的連線表示物質間可以反應。已知與戊的反應中:甲——戊的反應類型不同于其他幾個反應;丙——戊反應能產生一種氣體,且該氣體還能與丁反應生成沉淀。則下列對應關系正確的是( )
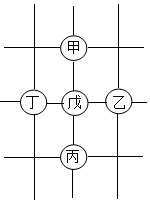
甲 乙 丙 丁 戊 A 鐵 氫氧化鋇 碳酸鈣 硝酸銀 稀鹽酸 B 硝酸銀 鐵 稀鹽酸 氫氧化鋇 碳酸鈣 C 硝酸銀 鐵 碳酸鈣 氫氧化鋇 稀鹽酸 D 鐵 硝酸銀 碳酸鈣 氫氧化鋇 稀鹽酸 A.A B.B C.C D.D 組卷:14引用:2難度:0.5 -
11.下列各組物質能在酸性無色溶液中大量共存的是( )
A.K2SO4、Ba(OH)2、KCl B.Na2CO3、KNO3、NH4Cl C.MgSO4、NaNO3、KCl D.Cu(NO3)2、NaCl、KNO3 組卷:46引用:2難度:0.5 -
12.小科在碳酸鈉溶液中滴加氯化鈣溶液,產生白色沉淀,然后再滴入適量經過稀釋的硫酸溶液.該實驗過程的操作如圖所示.下列有關操作與目的分析均正確的是( )
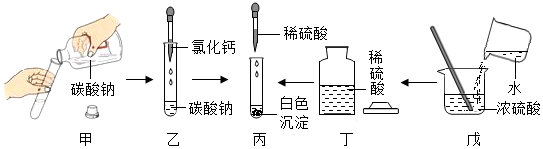
A.甲中試劑瓶標簽正對手心,是為了防止手被腐蝕 B.乙中將滴管伸入試管內,是為了防止試劑滴落到試管外 C.丁中試劑瓶蓋倒放在桌面上,主要是為了避免瓶中試劑受污染 D.戊中將水緩緩倒入濃硫酸并攪拌,是為了防止局部過熱引起酸液飛濺 組卷:35引用:12難度:0.5
四、解答題(共5小題,滿分30分)
-
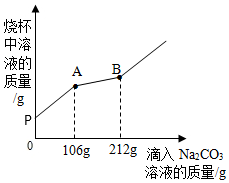 36.一燒杯中盛有200g CaCl2和HCl的混合溶液,向其中逐漸滴入溶質質量分數為10% Na2CO3溶液,所得溶液的質量與滴入的Na2CO3溶液的質量關系圖象如圖所示。
36.一燒杯中盛有200g CaCl2和HCl的混合溶液,向其中逐漸滴入溶質質量分數為10% Na2CO3溶液,所得溶液的質量與滴入的Na2CO3溶液的質量關系圖象如圖所示。
(1)在實驗過程中,其中出現冒氣泡現象的是(填“PA”或“AB”)段。
(2)原溶液中溶質HCl的質量是多少克?
(3)計算B點時燒杯中溶液(不飽和)溶質的質量分數為多少?(計算結果精確到0.1%)組卷:15引用:5難度:0.5 -
37.某研究性學習小組要測定市場上銷售的一種鈣片中碳酸鈣(CaCO3)的質量分數。查閱說明書和資料后發現,每粒鈣片的質量為1克,鈣片中除了碳酸鈣外還含有一定量的輔料,輔料不與酸、堿反應。于是他們設計了如下實驗方案:
步驟①:分別配制一定質量的溶質質量分數為3.65%的稀鹽酸和4%的NaOH溶液。
步驟②:將1粒鈣片研碎后,加入20克溶質質量分數為3.65%的稀鹽酸,待充分反應后過濾,測得濾液pH小于7。
步驟③:用溶質質量分數為4%的NaOH溶液逐滴加入濾液中,直至溶液pH等于7,測得消耗NaOH溶液的質量為10克。
(1)實驗中,用溶質質量分數為36.5%的濃鹽酸(密度約為1.2g/cm3),來配制100克溶質量分數為3.65%的稀鹽酸,至少需要濃鹽酸的體積為毫升。
(2)求這種鈣片中CaCO3的質量分數。(過程中涉及的反應有:NaOH+HCl═NaCl+H2O;CaCO3+2HCl═CaCl2+CO2↑+2H2O)
(3)小科根據碳酸鈣能受熱分解的原理,將研碎后的鈣片充分灼燒,根據灼燒前后固體的質量變化,計算出藥片中CaCO3的質量分數。若該方案合理,則輔料所滿足的性質為。組卷:65引用:5難度:0.5


