2022-2023學年山東省青島一中高一(上)期中化學試卷
發布:2024/12/22 5:30:4
一、單項選擇題:本題共15小題,每小題2分,共30分。每小題只有一個選項符合題目要求。
-
1.關于化學及人類社會發展歷程的說法中,錯誤的是( )
A.英國科學家波義耳提出的元素的概念,標志著近代化學的誕生 B.人們可以利用先進的技術和設備通過化學變化制造出新的原子和新的分子 C.道爾頓的“原子論”和阿伏加德羅的“分子學說”對化學的發展起到了極大推動作用 D.我國科學家合成了結晶牛胰島素,標志著人類在認識生命、探索生命奧秘的征途上邁出了關鍵的一步 組卷:8引用:2難度:0.7 -
2.下列關于鈉及其化合物的敘述正確的是( )
A.金屬鈉著火時,應使用二氧化碳滅火 B.NaHCO3俗稱純堿,可用作食品膨松劑 C.Na2CO3溶液與NaHCO3溶液可以用Ca(OH)2溶液進行鑒別 D.等質量的Na2CO3與NaHCO3與足量鹽酸反應,NaHCO3產生的CO2多 組卷:20引用:1難度:0.7 -
3.某同學想利用所學的知識去探究NO2的性質,設計了如下研究程序,最合理的是( )
A.觀察(得出NO2的物理性質)→實驗→分類(預測NO2的化學性質)→比較并得出結論 B.實驗→分類(預測NO2的化學性質)→觀察(得出NO2的物理性質)→比較并得出結論 C.分類(預測NO2的化學性質)→觀察(得出NO2的物理性質)→實驗→比較并得出結論 D.觀察(得出NO2的物理性質)→分類(預測NO2的化學性質)→實驗(觀察實驗現象、驗證預測)→比較得出結論,對于異常現象再預測,再實驗,再驗證 組卷:14引用:3難度:0.7 -
4.下列敘述正確的個數是( )
①H2SO4的摩爾質量為98
②物質的量是國際單位制中七個基本物理量之一
③阿伏加德羅常數可以近似表示為6.02×1023mol-1
④1molH2O2分子中含有1mol氫分子和1mol氧分子
⑤濃度為1mol?L-1的NaOH溶液的含義是1L水中含有40gNaOHA.2 B.3 C.4 D.5 組卷:21引用:2難度:0.5 -
5.下列有關物質的分類錯誤的是( )
A.NH3和蔗糖均屬于非電解質 B.將Na、Na2O2分別投入飽和NaOH溶液中,恢復原溫度,溶液濃度不變 C.NaHSO4和NaHCO3的水溶液均顯酸性 D.苛性鈉、純堿分別屬于堿和鹽 組卷:6引用:1難度:0.6 -
6.下列說法不正確的是( )
①氫氣能在氯氣中燃燒,生成白色煙霧
②銅絲在氯氣中燃燒,生成黃綠色的煙
③液氯是混合物,它能使干燥的有色布條褪色
④久置的氯水,溶液pH增大A.②③ B.①② C.①③④ D.①②③④ 組卷:21引用:1難度:0.7 -
7.在V mL Al2(SO4)3溶液中含有Al3+m g,取
mL該溶液用水稀釋至4V mL,則SO42-物質的量濃度為( )V4A. mol/L125m36VB. mol/L125m9VC. mol/L125m54VD. mol/L125m18V組卷:281引用:13難度:0.9 -
8.實驗室里做鈉與水反應的實驗時,下列儀器中需要用到的有( )種
①試管夾
②鑷子
③小刀
④濾紙
⑤研缽
⑥燒杯
⑦坩堝
⑧石棉網
⑨玻璃片A.3種 B.4種 C.5種 D.6種 組卷:9引用:1難度:0.7
二、非選擇題:根據題意填空、簡答(共4道大題,50分,答案填寫在答題卡上。)
-
24.(1)由幾種離子組成的混合物中可能含有下列離子中的若干種:K+、Na+、NH4+、Mg2+、Cu2+、CO32-、SO42-。將該混合物溶于水后得到澄清的溶液,現取三份各100mL該溶液分別進行如下實驗:
請回答下列問題:實驗序號 實驗內容 實驗結果 1 加入鹽酸 有氣泡產生 2 加入足量濃NaOH溶液并加熱 收集到標準狀況下的氣體1.12L 3 加入足量BaCl2溶液,對所得沉淀進行洗滌、干燥、稱量; 第一次稱量讀數為6.27g;再向沉淀中加入足量鹽酸,然后過濾、洗滌、干燥、稱量,第二次稱量讀數為2.33g
①實驗1說明存在的離子是(填離子符號,下同),一定不存在的離子是。
②由實驗2可知,100mL溶液中c(NH4+)=mol?L-1。
③由實驗3可知,100mL溶液中n(SO42-)=mol。
④溶液中c(Na+)的范圍是。
(2)電解質溶于水時會發生電離產生自由移動的離子,電導率變化一定程度上可以反映溶液中自由移動的離子濃度變化。在兩份相同的Ba(OH)2溶液中,分別滴入物質的量濃度相等的H2SO4、NaHSO4溶液,其導電能力隨滴入溶液體積變化的曲線如圖所示。下列分析正確的是。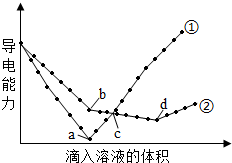
A.①代表滴加H2SO4溶液的變化曲線
B.b點,溶液中大量存在的離子是Na+、OH-
C.a、d兩點對應的溶液均顯中性
D.H+導電能力比Na+弱組卷:16引用:1難度:0.4 -
25.為驗證氧化性Cl2>Fe3+>SO2,某小組用如圖所示裝置進行實驗(夾持儀器和A中加熱裝置已略,氣密性已檢驗)。
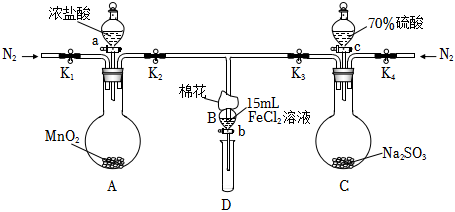
Ⅰ.打開彈簧夾K1~K4,通入一段時間N2,再將T型導管插入B中,繼續通入N2,然后關閉K1、K3、K4。
Ⅱ.打開活塞a,滴加一定量的濃鹽酸,給A加熱。
Ⅲ.當B中溶液變黃時,停止加熱,關閉K2。
Ⅳ.打開活塞b,使約2mL的溶液流入D試管中,檢驗其中的離子。
Ⅴ.打開K3和活塞c,加入70%的硫酸,一段時間后關閉K3。
Ⅵ.更新試管D,重復過程Ⅳ,檢驗B溶液中的離子。
(1)過程Ⅰ的目的是。
(2)棉花中浸潤的溶液為。
(3)A中發生反應的化學方程式:。
(4)若將制取的SO2通入酸性高錳酸鉀溶液可使溶液褪色,其離子方程式為。
(5)甲、乙、丙三位同學分別完成了上述實驗,結論如下表所示,他們的檢測結果一定能夠證明氧化性Cl2>Fe3+>SO2的是(填“甲”、“乙”或“丙”)。過程IVB溶液中含有的離子 過程VIB溶液中含有的離子 甲 有Fe3+無Fe2+ 有SO42- 乙 既有Fe3+又有Fe2+ 有SO42- 丙 有Fe3+無Fe2+ 有Fe2+ 組卷:10引用:1難度:0.5


