2022-2023學年黑龍江省大慶外國語學校九年級(下)第四次月考化學試卷
發布:2024/7/11 8:0:9
一、選擇題(單選共45分)
-
1.化學變化是人們改造和應用物質的主要途徑,下列轉化可通過化學變化實現的是( )
①O2分子轉化成O3分子
②碳﹣14轉化為碳﹣12
③鈣原子轉化成鈣離子
④氮元素轉化為碳元素A.①③ B.②④ C.①②④ D.①②③④ 組卷:29引用:2難度:0.9 -
2.以下是粗鹽提純的部分實驗操作圖,下列說法錯誤的是( )
A. 
玻璃棒的作用是加速溶解B. 
稱量10.5g粗鹽時,若指針左偏,應增加砝碼C. 
錯誤為未用玻璃棒引流D. 
當有大量固體析出時,應停止加熱組卷:217引用:4難度:0.6 -
3.下列化學方程式書寫正確的是( )
A.拉瓦錫測定空氣中氧氣含量實驗:4P+5O2 P2O5點燃B.溶洞的形成Ca(HCO3)2=CaCO3↓+H2O+CO2↑ C.人們認識水的組成開始:2H2O 2H2+O2↑通電D.鋁制品有較好抗腐蝕性的原因是:4Al+3O2=2Al2O3 組卷:33引用:2難度:0.6 -
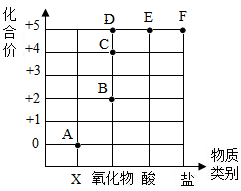 4.如圖表示元素的化合價與物質類別關系,若它表示氮元素的部分關系圖,則下列說法錯誤的是( )
4.如圖表示元素的化合價與物質類別關系,若它表示氮元素的部分關系圖,則下列說法錯誤的是( )A.C點表示物質的化學式可以為NO2 B.D點表示物質的化學式為N2O3 C.E點對應的物質是HNO3(屬于酸類物質) D.某化合物的化學式為KNO3(屬于鹽類物質),它代表的點是F 組卷:33引用:4難度:0.5 -
5.下列實驗方案設計正確的是( )
選項 實驗目的 實驗方案 A 除去CuO粉末中混有的少量C粉 在氧氣流中加熱 B 檢驗NaOH與HCl是否恰好完全反應 取樣,滴加AgNO3溶液觀察是否產生白色沉淀 C 除去NaOH溶液中的雜質Na2CO3 滴加適量BaCl2溶液,過濾 D 將100g98%的濃硫酸稀釋成40%的稀硫酸 將100g98%的濃硫酸緩慢倒入裝有245mL水的燒杯中,并用玻璃棒不斷的攪拌 A.A B.B C.C D.D 組卷:14引用:2難度:0.5 -
6.構建化學基本觀念是學好化學的基礎。下列關于水的認識不正確的是( )
A.元素觀:水是由氫元素和氧元素組成的 B.結構觀:水和冰的化學性質相同是因為分子構成相同 C.微粒觀:水是由氫分子和氧原子構成的 D.守恒觀:電解水實驗中,參加反應的水的質量等于反應后生成的氫氣和氧氣的質量之和 組卷:112引用:4難度:0.5 -
7.分析推理是化學學習中常用的思維方法。下列分析推理說法正確的是( )
A.Na+、Mg2+、Cl-的最外層電子數均為8,所以離子的最外層電子數均為8 B.氯化鈉、硫酸銅等鹽中都含有金屬元素,所以鹽中一定含有金屬元素 C.化合物含有不同種元素,則由同種元素組成的物質一定不是化合物 D.物質與氧氣發生的反應都是氧化反應,則氧化反應一定有氧氣參加反應 組卷:15引用:2難度:0.6
四、實驗題(18分)
-
22.金屬材料同人類文明的發展和社會的進步關系十分密切。
(一)認識鎂
(1)海水中含有大量的鈉元素與鎂元素,這兩種元素最本質的區別是不同(填“質子數”、“中子數”或“電子數”)。
(2)如表為三種元素原子的結構示意圖。
已知這三種原子的核外電子層數越多,原子半徑越大;核外電子層數相等時,核電荷數越多,原子半徑越小。這三種原子中半徑最小的是元素名稱 氮 氟 鎂 原子結構示意圖 

 。
。
(二)鐵的冶煉
實驗室用工業鐵紅(主要成分是Fe2O3,還含有少量的FeO、Fe3O4)模擬工業煉鐵并測定鐵紅中鐵元素的質量分數,進行了實驗,裝置如圖:
【資料】
1.草酸氫鈣是白色固體,化學式為Ca(HC2O4)2,加熱易分解,生成四種氧化物
2.NaOH溶液能很好地吸收CO2,堿石灰能吸收CO2和H2O。
【問題討論】
實驗前應先檢查裝置氣密性。
(3)寫出A中發生的反應化學方程式。
(4)進入E中的氣體是純凈、干燥的CO,則C、D中的試劑依次是、(選填序號)。
a.濃硫酸
b.澄清的石灰水
c.氫氧化鈉溶液
(5)實驗結束后,對E裝置停止加熱,繼續通入CO至冷卻,其目的是:。
(6)寫出E裝置中Fe2O3所發生的反應化學方程式。
(7)稱取鐵紅樣品7.0g,用上述裝置進行實驗,測定鐵紅中鐵元素的質量分數。實驗前后稱得F裝置增重4.4g,則此鐵紅中鐵元素的質量分數是。
【實驗反思】
(8)本實驗中如果缺少G裝置(不考慮其它因素),則測得樣品中鐵的質量分數會(填“偏大”、“不變”或“偏小”)。實驗裝置的一個明顯缺陷是沒有尾氣處理。組卷:19引用:2難度:0.4
五、計算題
-
 23.將50.0g鹽酸、氯化鎂和氯化鋁的混合溶液置于燒杯中,逐滴加入質量分數為20%的氫氧化鈉溶液。會產生氫氧化鋁和氫氧化鎂沉淀。加入氫氧化鈉溶液質量和生成沉淀質量的關系如圖所示。請根據題意回答問題:
23.將50.0g鹽酸、氯化鎂和氯化鋁的混合溶液置于燒杯中,逐滴加入質量分數為20%的氫氧化鈉溶液。會產生氫氧化鋁和氫氧化鎂沉淀。加入氫氧化鈉溶液質量和生成沉淀質量的關系如圖所示。請根據題意回答問題:
已知:Al(OH)3+NaOH═NaAlO2+2H2O
(1)鹽酸中溶質的化學式為,其相對分子質量為。
(2)B點溶液中所含溶質是(填化學式)。
(3)原混合溶液中MgCl2的質量分數是多少?(寫出計算過程)組卷:45引用:2難度:0.5


