2021-2022學年天津市咸水沽二中高二(上)期中化學試卷
發布:2024/4/20 14:35:0
一、單選題
-
1.下列依據熱化學方程式得出的結論正確的是( )
A.在25℃、101 KPa時,2 gH2完全燃燒生成液態水,放出285.8kJ熱量,氫氣燃燒熱的熱化學方程式為:2H2(g)+O2(g)═2H2O(l)△H=-285.8KJ?mol-1 B.CO(g)的燃燒熱是283.0 KJ/mol,則2CO2(g)═2CO(g)+O2(g)△H=2×283.0 KJ/mol C.在稀溶液中:H+(aq)+OH-(aq)=H2O(l);△H=-57.3 KJ?mol-1,若將含0.5 mol H2SO4的濃硫酸與含1 mol NaOH的溶液混合,放出的熱量大于57.3 KJ D.已知C(石墨,s)?C(金剛石,s)△H=+1.9 kJ/mol,則金剛石比石墨穩定 組卷:61引用:3難度:0.5 -
2.下列關于化學反應速率的說法正確的是( )
①恒溫時,增大壓強,化學反應速率一定加快
②其他條件不變,溫度越高,化學反應速率越快
③使用催化劑可改變反應速率,從而改變該反應過程中吸收或放出的熱量
④3mol?L-1?s-1的反應速率一定比1mol?L-1?s-1的反應速率大
⑤有氣體參加的化學反應,若增大壓強(即縮小反應容器的體積),可增加單位體積內活化分子數,從而使反應速率增大
⑥增大反應物濃度,可增大活化分子的百分數,從而使單位時間有效碰撞次數增多A.②⑥ B.②⑤ C.①②③⑤ D.①②④⑤ 組卷:228引用:17難度:0.9 -
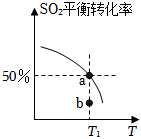 3.恒壓時,SO2和O2在起始濃度c(SO2)=c(O2)=2.0×10-2mol/L時發生反應:2SO2(g)+O2(g)?2SO3(g),測得不同溫度下SO2的平衡轉化率見如圖。有關說法正確的是( )
3.恒壓時,SO2和O2在起始濃度c(SO2)=c(O2)=2.0×10-2mol/L時發生反應:2SO2(g)+O2(g)?2SO3(g),測得不同溫度下SO2的平衡轉化率見如圖。有關說法正確的是( )A.若a點使用了催化劑,則b點未使用催化劑 B.該反應吸熱 C.若將起始n(SO2)和n(O2)變為原來的一半,圖象發生改變 D.T1℃時,平衡常數K= 2003組卷:141引用:6難度:0.5 -
4.向三個體積均為3L的恒容絕熱容器中,按不同方式投入反應物,500℃條件下開始發生如下反應:H2(g)+Br2(g)=2HBr(g)△H<0,測得達平衡時有關數據如表:
下列說法正確的是( )容器 Ⅰ Ⅱ Ⅲ 反應物投入量 1molH2、1molBr2 2molHBr 2molH2、2molBr2 平衡時正反應速率 v1 v2 v3 平衡常數 K1 K2 K3 平衡時H2的物質的量 n1 n2 n3 反應物的轉化率 α1 α2 α3 A.v1=v2 B.K1<K3 C.n1>n2 D.α1+α2>1 組卷:38引用:2難度:0.5 -
5.下列說法正確的是( )
A.熵增的反應都是自發的,自發反應的現象一定非常明顯 B.應該投入大量資金研究2CO(g)→2C(s)+O2(g)△H>0該過程發生的條件,以解決含碳燃料不充分燃燒引起的環境問題 C.常溫下,若反應A(s)+B(g)═C(g)+D(g)不能自發進行,則該反應的△H>0 D.已知C(s)+CO2(g) 2CO(g)△H>0,該反應是吸熱反應,一定不能自發進行高溫組卷:47引用:4難度:0.5 -
6.下列事實能用勒夏特列原理來解釋的是( )
A.SO2氧化SO3,往往需要使用催化劑2SO2(g)+O2(g)?2SO3(g) B.500℃左右的溫度比室溫更有利于合成氨反應N2(g)+3H2(g)?2NH3(g)△H<0 C.H2、I2、HI平衡混合氣體加壓后顏色加深H2(g)+I2(g)?2HI(g) D.實驗室采用排飽和食鹽水的方法收集氯氣Cl2+H2O?H++Cl-+HClO 組卷:117引用:28難度:0.7
二、填空題
-
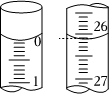 19.某研究性學習小組用濃度為0.20mol?L-1的鹽酸標準液滴定含有一定量雜質的燒堿樣品(雜質與酸不反應)溶于水形成的溶液。
19.某研究性學習小組用濃度為0.20mol?L-1的鹽酸標準液滴定含有一定量雜質的燒堿樣品(雜質與酸不反應)溶于水形成的溶液。
(1)準確量取一定體積的待測液需要使用的儀器是。
(2)若滴定開始和結束時,滴定管中的液面如圖所示,則消耗鹽酸標準液的體積為。
(3)用鹽酸標準液滴定待測燒堿樣品的溶液時,(填“左手”或“右手”,下同)握酸式
滴定管的活塞,搖動錐形瓶,眼睛始終注視。
(4)滴定時,若以酚酞為指示劑,滴定達到終點的標志是。
(5)將準確稱取的5.0g燒堿樣品配制成250mL待測液,并用鹽酸標準液滴定。滴定前讀數及滴定后讀數如下表所示。
由實驗數據可知,燒堿的純度為滴定次數 待測液體積(mL) 0.20mol?L的鹽酸體積(mL) 滴定前讀數 滴定后讀數 第一次 10.00 0.70 20.60 第二次 10.00 4.00 24.10 第三次 10.00 1.10 21.10
(6)下列操作會導致測得的待測液的濃度偏大的是(填字母)。
a.部分標準液滴出錐形瓶外
b.用待測溶液潤洗錐形瓶
c.錐形瓶洗凈后還留有蒸餾水
d.放出堿液的滴定管開始有氣泡,放出液體后氣泡消失組卷:117引用:6難度:0.5 -
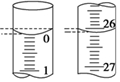 20.氧化還原滴定實驗與酸堿中和滴定類似(用已知濃度的氧化劑溶液滴定未知濃度的還原劑溶液或反之)。現用0.1000mol?L-1KMnO4酸性溶液滴定未知濃度的無色H2C2O4溶液,按要求完成下列問題:
20.氧化還原滴定實驗與酸堿中和滴定類似(用已知濃度的氧化劑溶液滴定未知濃度的還原劑溶液或反之)。現用0.1000mol?L-1KMnO4酸性溶液滴定未知濃度的無色H2C2O4溶液,按要求完成下列問題:
(1)該滴定實驗應選用(填“酸”或“堿”)式滴定管盛放高錳酸鉀溶液,原因是。
(2)寫出酸性高錳酸鉀與草酸反應的離子方程式。
(3)滴定終點的現象為。
(4)甲同學在滴定開始和結束時,觀察到裝標準液的滴定管的液面如圖所示,則本次滴定所消耗標準液的體積為。
(5)乙學生按照滴定步驟進行了3次實驗,分別記錄有關數據如表:
依據上表數據計算該H2C2O4溶液的物質的量濃度為滴定次數 待測H2C2O4溶液的體積/mL 0.1000mol?L-1 KMnO4的體積/mL 滴定前刻度 滴定后刻度 溶液體積/mL 第一次 25.00 0.00 26.11 26.11 第二次 25.00 1.56 30.30 28.74 第三次 25.00 0.22 26.31 26.09 mol/L(保留4位有效數字)。
(6)下列操作中可能使測定結果偏低的是(填字母)。
A.酸式滴定管未用標準液潤洗就直接注入KMnO4標準液
B.滴定前盛放草酸溶液的錐形瓶用蒸餾水洗凈后沒有干燥
C.酸式滴定管尖嘴部分在滴定前沒有氣泡,滴定后有氣泡
D.讀取KMnO4標準液時,開始仰視讀數,滴定結束時俯視讀數。組卷:33引用:2難度:0.6


