2021-2022學年陜西省西安市蓮湖區高二(下)期末化學試卷(B卷)
發布:2024/4/20 14:35:0
一、選擇題(本大題共16小題,每小題3分,計48分。每小題只有一個選項符合題意)
-
1.下列生活中的問題,不能用金屬鍵理論知識解釋的是( )
A.用鐵制品做炊具 B.用金屬鋁制成導線 C.用鉑金做首飾 D.鐵易生銹 組卷:198引用:11難度:0.9 -
2.下列能級中軌道數為3的是( )
A.s能級 B.p能級 C.d能級 D.f能級 組卷:121引用:15難度:0.9 -
3.區分晶體和非晶體最可靠的科學方法是( )
A.測定熔、沸點 B.觀察外形 C.對固體進行X射線衍射 D.通過比較硬度確定 組卷:145引用:14難度:0.9 -
4.某同學將A原子的核外電子排布式寫成
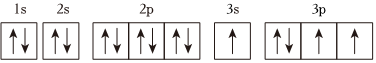 ,他違背了( )
,他違背了( )A.能量最低原理 B.泡利不相容原理 C.能量守恒原理 D.洪特規則 組卷:77引用:2難度:0.7 -
5.北京冬奧會國家速滑館用CO2代替氟利昂(氟氯代烴)、液氨等傳統制冷劑,采取跨臨界直冷制冰技術制造出更優質冰面。下列說法正確的是( )

A.減少氟利昂的使用可有效防治酸雨 B.CO2是含非極性鍵的極性分子 C.氨氣分子中氮原子的最外電子層具有8電子的穩定結構 D.冰是原子間通過共價鍵形成的原子晶體 組卷:7引用:2難度:0.8 -
6.下列微粒的空間結構與其VSEPR模型不一致的是( )
A.SO2 B.BF3 C.CH4 D.NH4+ 組卷:20引用:2難度:0.7 -
7.金屬晶體的堆積方式、空間利用率和配位數關系正確的是( )
A.鋅Zn-鎂型-68%-8 B.鈉Na-鉀型-74%-12 C.釙Po-簡單立方堆積-52%-6 D.銀Ag-銅型-74%-8 組卷:85引用:2難度:0.5
二、非選擇題(本大題共5小題,計52分)
-
20.A、B、C、D、E、F、G是元素周期表前四周期常見元素,且原子序數依次增大,其相關信息如表所示,請回答下列問題。
(1)A在元素周期表中的位置為A 原子核外有6個電子 B 原子序數比A大1 C 基態原子中s電子總數與p電子總數相等 D 原子半徑在同周期元素中最大 E 基態原子價層電子排布式為3s23p1 F 基態原子的最外層p軌道有2個電子的自旋狀態與其他電子的自旋狀態相反 G 生活中使用最多的一種金屬,其高價氯化物的鹽溶液常用于刻蝕銅制印刷電路板 ,畫出基態B原子的軌道表示式。
(2)B的簡單氣態氫化物的沸點(填“高于”或“低于”)PH3,原因是。
(3)A、B、C三種元素的電負性由高到低的排列次序為(用元素符號表示)。
(4)已知元素A、B形成的(AB)2鏈狀分子中所有的原子都滿足8電子穩定結構,則其分子中σ鍵與π鍵數目之比為。
(5)G元素可形成G2+、G3+,其中較穩定的是G3+,原因是。
(6)短周期元素M與元素E在周期表中的位置呈現對角線關系,已知元素M、F的電負性分別為1.5和3.0,預測它們形成的化合物是(填“離子”或“共價”)化合物。推測M的最高價氧化物對應的水化物(填“能”或“不能”)與D的最高價氧化物對應水化物發生反應。組卷:14引用:2難度:0.4 -
21.Cu-Mn-Al合金為磁性形狀記憶合金材料之一,可用來制作各種新型的換能器、驅動器、敏感元件和微電子機械操縱系統。
(1)寫出基態銅原子的核外電子排布式:。
(2)焰火中的綠色是銅的焰色,基態銅原子在灼燒時價電子發生了而變為激發態。
(3)新型農藥松脂酸銅具有低殘留的特點,如圖是松脂酸銅的結構簡式: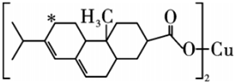
1個松脂酸銅中π鍵的個數為,加“*”碳原子的雜化方式為。
(4)氯化鋁的熔點為181℃,氮化鋁的熔點高達2249℃,它們都是活潑金屬和非金屬的化合物,熔點相差大的原因是。
(5)Cu-Mn-Al合金的晶胞如圖1所示,該晶胞可視為Mn、Al位于Cu形成的立方體體心位置,圖2是沿立方格子對角面取得的截圖。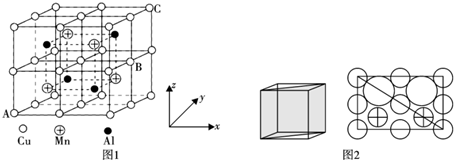
①若A原子的坐標參數為(0,0,0),C為(1,1,1),則B原子的坐標參數為。
②由晶胞可知該合金的化學式為。
③已知原子半徑r(Cu)≈r(Mn)=127pm,r(Al)=143pm,則Cu原子之間的最短核間距離為pm。
④該晶胞的密度為g?cm-3。(列出計算式即可,阿伏加德羅常數用NA表示)組卷:13引用:2難度:0.5


