2019-2020學年山東省濟南外國語學校(三箭分校)高三(上)期中化學試卷
發布:2024/4/20 14:35:0
一、選擇題(單選,每小題3分共48分)
-
1.《本草綱目》中對利用K2CO3 去油污有如下敘述:“冬月灶中所燒薪柴之灰,令人以灰淋汁,取堿烷衣。”文中涉及的化學反應屬于( )
A.水解反應 B.置換反應 C.酯化反應 D.加成反應 組卷:13引用:6難度:0.7 -
2.下列水解方程式的書寫不正確的是( )
A.NH4++H2O?NH3?H2O+H+ B.S2-+2H2O?H2S+2OH- C.CH3COOC2H5 +H2O?CH3COOH+C2H5OH D.MgCO3 +H2O Mg(OH)2 +CO2△組卷:18引用:2難度:0.8 -
3.電解質溶液的電導率越大,導電能力越強.用0.1mol?L-1的NaOH溶液分別滴定體積均為10.00mL濃度均為0.1mol?L-1的鹽酸和CH3COOH溶液,利用傳感器測得滴定過程中溶液的電導率如圖所示.下列說法不正確的是( )
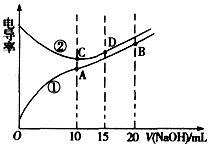
A.曲線①代表滴定CH3COOH溶液的曲線 B.A點溶液中:c(CH3COO-)+c(OH-)-c(H+)=0.05 mol?L-1 C.在相同溫度下,A、B、C三點溶液中水電離的c(H+):B<A=C D.D點溶液中:c(Cl-)=2c(OH-)-2c(H+) 組卷:42引用:4難度:0.7 -
4.下列關于熱化學反應的描述中正確的是( )
A.HCl和NaOH反應的中和熱△H=-57.3 kJ?mol-1,則H2SO4和Ca(OH)2反應的中和熱△H=2×(-57.3)kJ?mol-1 B.CO(g)的燃燒熱是283.0 kJ?mol-1,則2CO2(g)═2CO(g)+O2(g)的△H=2×(+283.0)kJ?mol-1 C.需要加熱才能發生的反應一定是吸熱反應 D.1 mol甲烷燃燒生成氣態水和二氧化碳所放出的熱量是甲烷的燃燒熱 組卷:94引用:12難度:0.9 -
5.肼(N2H4)是火箭發動機的燃料,它與N2O4反應時,N2O4為氧化劑,生成氮氣和水蒸氣.已知:N2(g)+2O2(g)═N2O4(g)△H=+8.7kJ/mol,N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534.0kJ/mol,下列表示肼跟N2O4反應的熱化學方程式,正確的是( )
A.2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g)△H=-542.7 kJ/mol B.2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g)△H=-1 059.3 kJ/mol C.2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g)△H=-1 076.7 kJ/mol D.N2H4(g)+ N2O4(g)═12N2(g)+2H2O(g)△H=-1 076.7 kJ/mol32組卷:50引用:7難度:0.9 -
6.下列實驗方案不能達到相應目的是( )
A B C D 目的 比較碳酸根與碳酸氫根水解程度 研究濃度對化學平衡的影響 比較不同催化劑對化學反應速率的影響 比較碳酸、醋酸和硼酸的酸性強弱 實驗方案 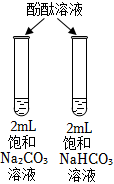
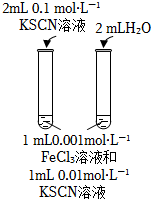
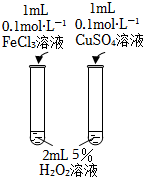
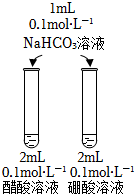
A.A B.B C.C D.D 組卷:56引用:6難度:0.6 -
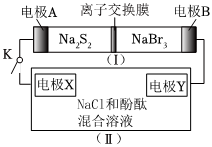 7.如圖所示,裝置(Ⅰ)是一種可充電電池,裝置(Ⅱ)為電解池,裝置(Ⅰ)的離子交換膜只允許Na+通過。電池充、放電的化學方程式為:
7.如圖所示,裝置(Ⅰ)是一種可充電電池,裝置(Ⅱ)為電解池,裝置(Ⅰ)的離子交換膜只允許Na+通過。電池充、放電的化學方程式為:
2Na2S2+NaBr3Na2S4+3NaBr,當閉合K時,X極附近溶液變紅色。放電充電
下列說法正確的是( )A.裝置(I)中Na+從右到左通過離子交換膜 B.A電極的電極反應式為:NaBr3+2Na++2e-=3NaBr C.X電極的電極反應式為:2Cl--2e-=Cl2↑ D.每有0.1mol Na+通過離子交換膜,X電極上就生成標準狀況下氣體1.12L 組卷:12引用:6難度:0.7
二、非選擇題,共52分
-
 20.現有常溫條件下濃度均為0.1mol?L-1 的甲、乙、丙、丁四種溶液,甲為NaOH溶液,乙為HCl溶液,丙為CH3COOH溶液,丁為氨水,已知Ka(CH3COOH)=Kb(NH3?H2O)。試回答下列問題:
20.現有常溫條件下濃度均為0.1mol?L-1 的甲、乙、丙、丁四種溶液,甲為NaOH溶液,乙為HCl溶液,丙為CH3COOH溶液,丁為氨水,已知Ka(CH3COOH)=Kb(NH3?H2O)。試回答下列問題:
(1)甲、丁溶液中由水電離出的c(OH-)的大小關系為甲(填“大于”、“小于”或“等于”)丁。
(2)將一定體積的甲與乙混合,所得溶液pH=12,則二者的體積之比為V甲:V乙=。
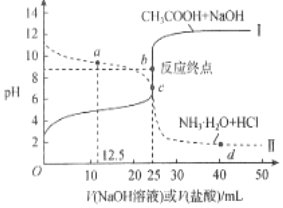
(3)某同學用甲溶液滴定丙溶液、乙溶液滴定丁溶液,得到如圖所示兩條滴定曲線,請完成有關各題:
①乙溶液滴定丁溶液最適合的指示劑是;甲溶液滴定丙溶液,選用酚酞為指示劑,則達到滴定終點的標志是。
②計算滴定至b點時,c(CH3COOH)+c(CH3COO-)=mol?L-1。
③向氨水中滴加鹽酸至a點,溶液中離子濃度從大到小的順序為;若加鹽酸VmL時,溶液恰好呈中性,用含V的代數式表示Kb=。(不考慮溶液混合體積變化)組卷:5引用:2難度:0.6 -
 21.煤燃燒排放的煙氣含有SO2和NOx,形成酸雨、污染大氣,采用NaClO2溶液作為吸收劑可同時對煙氣進行脫硫、脫硝,回答下列問題:
21.煤燃燒排放的煙氣含有SO2和NOx,形成酸雨、污染大氣,采用NaClO2溶液作為吸收劑可同時對煙氣進行脫硫、脫硝,回答下列問題:
(1)在鼓泡反應器中通入含有SO2和NOx的煙氣,反應溫度為323K,NaClO2堿性溶液濃度為5×10-3mol?L-1。反應一段時間后溶液中離子濃度的分析結果如下表。
①寫出NaClO2堿性溶液脫硝(NO)過程中主要反應的離子方程式:離子 SO42- SO32- NO3- NO2- Cl- c/mol?L-1 8.35×10-4 6.87×10-6 1.5×10-4 1.2×10-5 3.4×10-3 。增加壓強,NO的轉化率(填“提高”“不變”或“降低”)。
②由實驗結果可知,脫硫反應速率大于脫硝反應速率,原因是除了SO2和NO在煙氣中的初始濃度不同,還可能是。
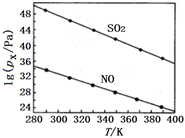
(2)在不同溫度下,NaClO2溶液脫硫、脫硝的反應中,SO2和NO的平衡分壓px如圖所示。由圖分析可知,反應溫度升高,脫硫、脫硝反應的平衡常數均(填“增大”“不變”或“減小”)。
(3)如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到較好的煙氣脫硫效果。從化學平衡原理分析,Ca(ClO)2相比NaClO具有的優點是。組卷:4引用:1難度:0.5


