2022-2023學年江蘇省南通市海安高級中學高二(上)期中化學試卷
發(fā)布:2024/4/20 14:35:0
一、單項選擇題(本題包括13小題,每小題3分,共計39分。每小題只有一個選項符合題目要求。)
-
1.化學與生活息息相關,下列敘述錯誤的是( )
A.運載火箭燃料使用的液氫是高能清潔燃料 B.農村推廣風力發(fā)電、光伏發(fā)電有利于“碳達峰、碳中和” C.明礬和二氧化氯均可作凈水劑,且凈水原理相同 D.銨態(tài)氮肥應避光保存且避免和堿性肥料混合使用 組卷:5引用:1難度:0.7 -
2.最近《科學》雜志評出10大科技突破,其中“火星上‘找’到水的影子”名列第一。下列關于水的說法中正確的是( )
A.pH=6的水一定呈酸性 B.溫度升高,純水中的c(H+)增大,c(OH-)減小 C.pH=10的氨水與pH=4的NH4Cl溶液中,水電離出的c(H+)之比為1:1 D.25℃時某溶液中由水電離產(chǎn)生的c(H+)=1×10-13mol?L-1,該溶液可能顯酸性 組卷:44引用:1難度:0.8 -
3.閱讀下列資料,完成3~4題:液氨是一種很好的溶劑,液氨可以微弱的電離產(chǎn)生NH2-和NH4+。NH3中的一個H原子若被-NH2取代可形成N2H4(聯(lián)氨),若被-OH取代可形成NH2OH(羥胺)。在有NH4+存在時,Cu(OH)2能溶于氨水形成[Cu(NH3)4]2+。NH3經(jīng)過一定的轉化可以形成N2、NO、NO2、N2O4(無色)、HNO3等。
下列有關NH2OH、NH3、NH4+、NO3-的說法正確的是( )A.NH2OH難溶于水 B.四種微粒中N原子的雜化方式皆為sp3 C.NH3的鍵角比NH2-中的大 D.1mol[Cu(NH3)4]2+中含有σ鍵的數(shù)目為12mol 組卷:9引用:0難度:0.60 -
4.閱讀下列資料,完成3~4題:液氨是一種很好的溶劑,液氨可以微弱的電離產(chǎn)生NH2-和NH4+。NH3中的一個H原子若被-NH2取代可形成N2H4(聯(lián)氨),若被-OH取代可形成NH2OH(羥胺)。在有NH4+存在時,Cu(OH)2能溶于氨水形成[Cu(NH3)4]2+。NH3經(jīng)過一定的轉化可以形成N2、NO、NO2、N2O4(無色)、HNO3等。
對于反應N2(g)+3H2(g)?2NH3(g)△H< 0,下列說法正確的是( )A.縮小容器體積,N2的濃度比壓縮前大 B.及時將產(chǎn)生的氨氣液化分離,可加快正反應速率 C.升高溫度,該反應的正反應速率減小,逆反應速率增大 D.選用優(yōu)質催化劑,能夠降低合成氨反應的焓變 組卷:10引用:0難度:0.60 -
5.下列敘述中不正確的是( )
A.常溫下,NH3(g)+HCl(g)=NH4Cl(s) 能夠自發(fā)進行,則該反應的△H<0 B.需加熱才能進行的反應是吸熱反應,不需加熱就能進行的反應是放熱反應 C.C(金剛石,s)=C(石墨,s)△H=-1.9kJ?mol-1,則石墨比金剛石穩(wěn)定 D.常溫下,0.1mol?L-1CH3COONa溶液加水稀釋后,溶液中 的值增大c(CH3COOH)c(CH3COO-)組卷:10引用:2難度:0.6
二、解答題(共4小題,滿分61分)
-
16.檸檬酸亞鐵(FeC6H6O7)是一種易被人體吸收的高效鐵制劑,醫(yī)療上可以用來治療缺鐵性貧血。某課題組以硫鐵礦燒渣(含F(xiàn)e2O3、SiO2、少量Al2O3等)為原料,先制備碳酸亞鐵,再與檸檬酸反應可以制得檸檬酸亞鐵。其工藝流程如圖:
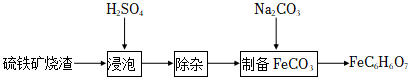
已知:相關金屬離子生成氫氧化物沉淀的pH(開始沉淀的pH按金屬離子濃度為1.0mol?L-1計算):
(1)基態(tài)Fe2+的核外電子排布式為金屬離子 沉淀開始pH 沉淀完全pH Al3+ 3.1 5.1 Fe2+ 5.9 6.9 Fe3+ 1.2 3.2 。
(2)“浸泡”時加入過量硫酸的目的:。
(3)“除雜”時有同學提出下列兩種途徑,請選擇較合理的途徑并說明理由。
途徑一: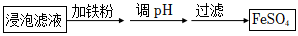
途徑二: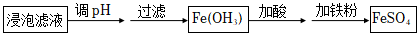
(4)“制備FeCO3”時,Na2CO3溶液的濃度對沉淀中鐵元素的質量分數(shù)以及FeCO3產(chǎn)率的影響如圖: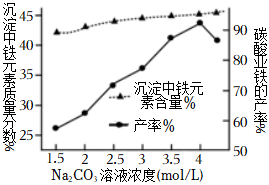
Na2CO3溶液的濃度大于4mol/L時,F(xiàn)eCO3的產(chǎn)率有所下降,而沉淀中鐵元素質量分數(shù)仍在上升的原因是。
(5)已知檸檬酸亞鐵易被氧化,能溶于水,不溶于乙醇。設計試驗方案,從“除雜”后的FeSO4溶液制備檸檬酸亞鐵晶體:,靜置、過濾、洗滌、干燥,獲得檸檬酸亞鐵晶體。(必須用到的試劑有:Fe粉、4mol/LNa2CO3溶液、檸檬酸溶液、無水乙醇)
(6)產(chǎn)品純度的測定。產(chǎn)品中鐵的含量用EDTA配位滴定法測定:稱取0.4000g產(chǎn)品中加入足量H2O2溶液和適量的稀H2SO4,充分反應后再用0.0600mol?L-1EDTA溶液滴定至終點(其他離子對滴定過程無干擾),消耗EDTA溶液的體積為20.00mL(已知:EDTA與Fe3+的滴定比例為1:1,檸檬酸亞鐵的摩爾質量為246g/mol)。計算產(chǎn)品的純度為。
(7)上述滴定過程中,導致測定結果偏大的是。
a.滴定前,盛裝EDTA的酸式滴定管未潤洗
b.滴定時,酸式滴定管中開始有氣泡,后來無氣泡
c.滴定開始時平視,滴定結束時俯視組卷:19引用:1難度:0.5 -
17.氮的氧化物是造成大氣污染的主要物質。研究氮氧化物的反應機理對于消除環(huán)境污染有重要意義。
(1)催化氧化法去除NO是在一定條件下,用NH3消除NO污染,其反應原理為:4NH3+6NO5N2+6H2O。不同溫度條件下,n(NH3):n(NO)的物質的量之比分別為4:1、3:1、1:3時,得到NO脫除率曲線如圖1所示。催化劑△
①n(NH3):n(NO)的物質的量之比為1:3時,對應的是曲線(填“a”“b”或“c”)。
②由圖1可知,無論以何種比例反應,在溫度超過900℃時NO脫除率都會驟然下降的原因可能是。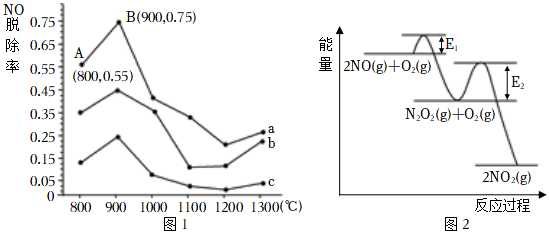
(2)NO氧化反應:2NO(g)+O2(g)?2NO2(g)分兩步進行,其反應過程能量變化示意圖如圖2。
Ⅰ.2NO(g)→N2O2(g)ΔH1
Ⅱ.N2O2(g)+O2(g)→2NO2(g)ΔH2
①化學反應速率由速率較慢的反應步驟決定。以上反應決定NO氧化反應速率的步驟是(填“Ⅰ”或“Ⅱ”)。
②在恒容的密閉容器中充入一定量的NO和O2氣體,保持其他條件不變,控制反應溫度分別為T3和T4(T4>T3),測得c(NO)隨t(時間)的變化曲線如圖3。轉化相同量的NO,在溫度(填“T3”或“T4”)下消耗的時間較長,試結合反應過程能量圖(圖2)分析其原因:。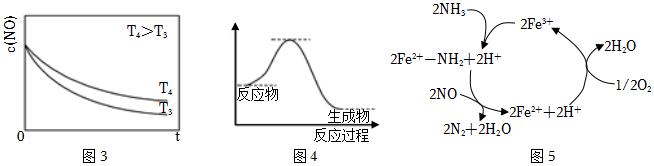
(3)NH3催化還原NO是重要的煙氣脫硝技術,其反應過程與能量關系如圖4;研究發(fā)現(xiàn)在以Fe2O3為主的催化劑上可能發(fā)生的反應過程如圖5,寫出脫硝過程的總反應方程式:。組卷:16引用:1難度:0.6


