2017-2018學年北京二中高二(上)期中化學試卷
發布:2024/11/25 4:0:2
一、選擇題(每小題2分,共50分)
-
1.下列說法不正確的是( )
A.煤燃燒是化學能轉化為熱能的過程 B.化石燃料和植物燃料燃燒時放出的能量均來源于太陽能 C.給電池進行充電是電能轉變成化學能的過程 D.植物通過光合作用將CO2轉化為葡萄糖是太陽能轉變成熱能的過程 組卷:2引用:2難度:0.6 -
2.下列物質的水溶液能導電,屬于強電解質的是( )
A.冰醋酸 B.明礬 C.SO3 D.C2H5OH 組卷:13引用:2難度:0.8 -
3.在2A+B═3C+4D反應中,表示該反應速率最快的數據是( )
A.v(A)=0.5 mol?L-1?s-1 B.v(B)=0.3 mol?L-1?s-1 C.v(C)=0.8 mol?L-1?s-1 D.v(D)=1.0 mol?L-1?s-1 組卷:67引用:13難度:0.7 -
4.在密閉容器中進行反應X2(g)+Y2(g)?2Z(g),已知X2、Y2、Z的起始濃度分別為0.1mol?L-1、0.2mol?L-1、0.2mol?L-1,在一定條件下,當反應達到平衡時,各物質的濃度有可能是( )
A.Z為0.2mol?L-1 B.Y2為0.35mol?L-1 C.X2為0.3mol?L-1 D.Z為0.4mol?L-1 組卷:20引用:3難度:0.7 -
5.對于合成氨反應,達到平衡后,以下分析正確的是( )
A.升高溫度,對正反應的反應速率影響更大 B.增大壓強,對正反應的反應速率影響更大 C.減小反應物濃度,對逆反應的反應速率影響更大 D.加入催化劑,對逆反應的反應速率影響更大 組卷:804引用:36難度:0.9 -
6.某混合溶液中所含離子的濃度如下表,則M離子可能為( )
所含離子 NO3- SO42- H+ M 濃度/(mol?L-1) 2 1 2 1 A.Cl- B.Ba2+ C.F- D.Mg2+ 組卷:4引用:1難度:0.6 -
7.將濃度為0.1mol?L-1的HF溶液加水不斷稀釋,下列各量始終保持增大的是( )
A.c(H+) B.Ka(HF) C.c(F-)/c(H+) D.c(H+)/c (HF) 組卷:46引用:5難度:0.9 -
8.下列說法正確的是( )
A.Ba(OH)2?8H2O與NH4Cl的反應、鋁片與稀鹽酸的反應都是放熱反應 B.酸、堿稀溶液的中和熱方程式可表示為:H+(aq)+OH-(aq)=H2O(1)△H=-57.3kJ/mol C.由C(石墨)→C(金剛石)△H=+1.9kJ/mol可知,金剛石比石墨穩定 D.活化能對化學反應前后的能量變化不產生任何影響 組卷:3引用:2難度:0.6 -
9.已知在25℃,101kPa下,lgC8H18(辛烷)燃燒生成二氧化碳和液態水時放出48.40kJ熱量.表示上述反應的熱化學方程式正確的是( )
A.C8H18(l)+22.5O2(g)═8CO2(g)+9H2O(g);△H=-48.40kJ?mol-1 B.C8H18(l)+22.5O2(g)═8CO2(g)+9H2O(l);△H=-5518kJ?mol-1 C.C8H18(l)+22.5O2(g)═8CO2(g)+9H2O(l);△H=+5518kJ?mol-1 D.C8H18(l)+22.5O2(g)═8CO2(g)+9H2O(l);△H=-48.40kJ?mol 組卷:58引用:8難度:0.9 -
10.下列事實,不能用勒夏特列原理解釋的是( )
A.向雙氧水中加入MnO2,立即產生大量氣泡 B.硫酸工業中,增大O2的濃度有利于提高SO2的轉化率 C.合成氨工廠通常采用20MPa~50MPa壓強,以提高原料的轉化率 D.用排飽和食鹽水法收集Cl2 組卷:12引用:2難度:0.5
二、填空題
-
 29.2SO2(g)+O2(g)?2SO3(g)反應過程的能量變化如圖所示.已知1mol SO2(g)氧化為1mol SO3(g)的△H=-99kJ?mol-1.請回答下列問題:
29.2SO2(g)+O2(g)?2SO3(g)反應過程的能量變化如圖所示.已知1mol SO2(g)氧化為1mol SO3(g)的△H=-99kJ?mol-1.請回答下列問題:
(1)圖中A、C分別表示、,E的大小對該反應的反應熱(填“有”或“無”)影響.該反應通常用V2O5作催化劑,加V2O5會使圖中B點(填“升高”還是“降低”),△H(填“變大”、“變小”或“不變”),理由是
(2)圖中△H=kJ?mol-1;
(3)V2O5的催化循環機理可能為:V2O5氧化SO2時,自身被還原為四價釩化合物;四價釩化合物再被氧氣氧化為V2O5.寫出該催化循環機理的化學方程式、.
(4)已知單質硫的燃燒熱為296kJ?mol-1,計算由S(s)生成3molSO3(g)的△H(要求計算過程).組卷:58引用:10難度:0.5 -
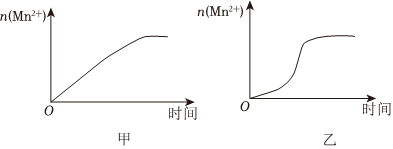 30.某化學小組為了研究外界條件對化學反應速率的影響,進行了如下實驗:
30.某化學小組為了研究外界條件對化學反應速率的影響,進行了如下實驗:
【實驗原理】2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O
【實驗內容及記錄】
請回答:實驗編號 室溫下,試管中所加試劑及其用量/mL 室溫下溶液顏色褪至無色所需時間/min 0.6 mol/L
H2C2O4溶液H2O 0.2 mol/L KMnO4溶液 3 mol/L
稀硫酸1 3.0 2.0 3.0 2.0 4.0 2 3.0 3.0 2.0 2.0 5.2 3 3.0 4.0 1.0 2.0 6.4
(1)根據上表中的實驗數據,可以得到的結論是.
(2)利用實驗1中數據計算,用KMnO4的濃度變化表示的反應速率為:υ(KMnO4)=.
(3)該小組同學根據經驗繪制了n(Mn2+) 隨時間變化趨勢的示意圖,如圖1所示.但有同學查閱已有的實驗資料發現,該實驗過程中n(Mn2+) 隨時間變化的趨勢應如圖2所示.該小組同學根據圖2所示信息提出了新的假設,并繼續進行實驗探究.
①該小組同學提出的假設是.
②請你幫助該小組同學完成實驗方案,并填寫表中空白.
③若該小組同學提出的假設成立,應觀察到的現象是實驗編號 室溫下,試管中所加試劑及其用量/mL 再向試管中加入少量固體 室溫下溶液顏色褪至無色所需時間/min 0.6 mol/L
H2C2O4溶液H2O 0.2 mol/L KMnO4溶液 3 mol/L
稀硫酸4 3.0 2.0 3.0 2.0 t .組卷:68引用:20難度:0.1


