2022-2023學年四川省成都八中高二(上)期中化學試卷
發布:2024/9/9 1:0:8
一、單選題(共20題,每小題2分,共40分)
-
1.下列說法中正確的是( )
A.硫代硫酸鈉和稀硫酸反應會出現渾濁現象 B.配制0.5mol/L的NaOH溶液240mL,需要稱量NaOH4.8g C.平衡混合物中各組分濃度改變,平衡一定會移動 D.化學反應中的能量變化都表現為熱量的變化 組卷:1引用:1難度:0.8 -
2.下列說法正確的是( )
A.非自發的反應一定可以通過改變條件使其成為自發反應 B.相同物質的量的同種物質氣態時熵值最小,固態時熵值最大 C.反應NH3(g)+HCl(g)?NH4Cl(s)在室溫下可自發進行,則該反應的ΔH<0 D.恒溫恒壓下,ΔH<0且ΔS>0的反應一定不能自發進行 組卷:98引用:15難度:0.7 -
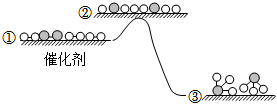 3.H2與N2在催化劑表面生成NH3,反應歷程及能量變化示意如圖。下列說法錯誤的是( )
3.H2與N2在催化劑表面生成NH3,反應歷程及能量變化示意如圖。下列說法錯誤的是( )A.該反應為放熱反應 B.①→②:斷開H-H鍵和N≡N時需要吸收能量 C.②→③:原子重新組合形成了N-H鍵 D.選擇不同的催化劑會改變此反應△H的數值 組卷:76引用:6難度:0.5 -
4.已知:①C(s)+O2(g)=CO2(g)ΔH=-393.5 kJ/mol
②4Fe(s)+3O2(g)=2Fe2O3(s)ΔH=-1648.8 kJ/mol
則2Fe2O3(s)+3C(s)=3CO2(g)+4Fe(s)的ΔH是( )A.-169.4kJ/mol B.+468.3kJ/mol C.-627.6kJ/mol D.-744.7kJ/mol 組卷:11引用:1難度:0.6 -
5.下列對化學反應速率增大原因的分析錯誤的是( )
A.升高溫度,使反應物分子中活化分子百分數增大 B.向反應體系中加入相同濃度的反應物,使活化分子百分數增大 C.對有氣體參加的化學反應,增大壓強使容器容積減小,單位體積內活化分子數增多 D.加入適宜的催化劑,使反應物分子中活化分子百分數增大 組卷:410引用:17難度:0.6 -
6.下列關于化學平衡常數的說法中錯誤的是( )
A.化學平衡常數只與反應本身及溫度有關 B.催化劑不能改變平衡常數的大小 C.平衡常數發生改變,化學平衡必發生改變 D.化學平衡移動時,平衡常數必改變 組卷:7引用:1難度:0.7 -
7.下列有關化學反應速率的說法正確的是( )
A.20 mL 4 mol/L的硫酸與鐵片反應時,加入氯化鉀溶液,反應速率不變 B.增加反應物的質量,反應速率一定加快 C.合成氨是一個放熱反應,升高溫度,正反應速率減慢 D.0.1mol/L鹽酸和0.1mol/LHNO3分別與大小相同的大理石反應的速率相同 組卷:5引用:1難度:0.5 -
8.以太陽能為熱源,熱化學硫碘循環分解水是一種高效、環保的制氫方法,其流程圖如圖:
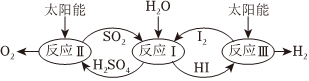
相關反應的熱化學方程式為
反應Ⅰ:SO2(g)+I2(g)+2H2O(l)═2HI(aq)+H2SO4(aq)ΔH1=-213kJ/mol
反應Ⅱ:H2SO4(aq)═SO2(g)+H2O(l)+O2(g)ΔH2=+327kJ/mol12
反應Ⅲ:2HI(aq)═H2(g)+I2(g)ΔH3=+172kJ/mol
下列說法不正確的是( )A.該過程實現了太陽能到化學能的轉化 B.SO2和I2對總反應起到了催化劑的作用 C.總反應的熱化學力程式為2H2O(l)═2H2(g)+O2(g)ΔH=+286kJ/mol D.該過程使水分解制氫反應更加容易發生,但總反應的ΔH不變 組卷:175引用:8難度:0.6
二、填空題(共5題,共60分)
-
 24.肼(N2H4)是一種良好的火箭推進劑,其與適當的氧化劑(如過氧化氫、氧氣等)配合,可組成比沖最高的可貯存液體推進劑。
24.肼(N2H4)是一種良好的火箭推進劑,其與適當的氧化劑(如過氧化氫、氧氣等)配合,可組成比沖最高的可貯存液體推進劑。
(1)液態肼和液態過氧化氫混合反應時,即產生大量氮氣和水蒸氣,并放出大量熱。若每生成1molN2,放出642kJ的熱量,則該反應的熱化學方程式為,消耗16g液態肼放出的熱量為。
(2)已知:N2H4(g)+O2(g)=N2(g)+2H2O(g)ΔH=-544kJ?mol-1,鍵能數據如下表:
則氮氮三鍵的鍵能為化學鍵 N-N N-H O=O O-H 鍵能/(kJ?mol-1) 193 391 497 463 。若H2O(l)=H2O(g)ΔH=+44kJ?mol-1,則N2H4(g)的燃燒熱為。
(3)已知:N2(g)+2O2(g)=2NO2(g)ΔH=+68kJ?mol-1,則肼(g)和二氧化氮(g)反應生成氮氣和水蒸氣的熱化學方程式為。組卷:55引用:4難度:0.7 -
25.氧化劑H2O2在反應時不產生污染物,被稱為綠色氧化劑,因而受到人們越來越多的關注。某實驗小組以H2O2分解為例,探究濃度、催化劑、溫度對反應速率的影響。在常溫下按照下表所示的方案完成實驗。
(1)實驗①和②的目的是實驗編號 溫度(℃) 反應物 催化劑 ① 20 25mL3%H2O2溶液 無 ② 20 25mL5%H2O2溶液 無 ③ 20 25mL5%H2O2溶液 0.1gMnO2 ④ 20 25mL5%H2O2溶液 1~2滴1mol/LFeCl3溶液 ⑤ 30 25mL5%H2O2溶液 0.1gMnO2 。同學甲在進行實驗①和②時并沒有觀察到明顯現象。資料顯示,通常條件下過氧化氫穩定,不易分解。為了達到實驗目的,可采取的改進方法是(寫出一種即可)。
(2)實驗③、④、⑤中,測得生成氧氣的體積隨時間變化如圖所示。分析該圖能得出的結論是。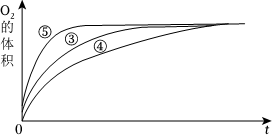
(3)同學乙設計了如圖所示的實驗裝置對過氧化氫的分解速率進行定量分析,以生成20mL氣體為準,其他影響實驗的因素均已忽略。實驗中需要測量的數據是。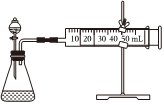
(4)向某體積固定的密閉容器中加入0.6molA、0.2molC和一定量(未知)的B三種氣體,一定條件下發生反應,各物質濃度隨時間變化如圖所示。已知在反應過程中混合氣體的平均相對分子質量沒有變化。請回答: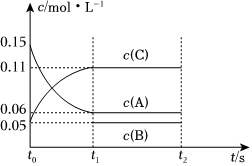
①寫出反應的化學方程式:;
②B的起始的物質的量是;平衡時體系內的壓強為初始狀態的倍。組卷:26引用:1難度:0.7


