2022-2023學(xué)年重慶市巴蜀中學(xué)高三(上)月考化學(xué)試卷(二)
發(fā)布:2024/4/20 14:35:0
一、選擇題:本題共14小題,每小題3分.在每小題給出的四個(gè)選項(xiàng)中,只有一項(xiàng)是符合題目要求的.
-
1.化學(xué)與科技、生產(chǎn)、生活有密切的關(guān)系,下列敘述不正確的是( )
A.我國(guó)海洋開(kāi)發(fā)走向“深藍(lán)時(shí)代”,大型艦船的底部常鑲嵌鋅塊做負(fù)極,防止船底腐蝕 B.“一帶一路”是“絲綢之路經(jīng)濟(jì)帶”和“21世紀(jì)海上絲綢之路”的簡(jiǎn)稱.絲綢的主要成分是蛋白質(zhì),屬于高分子化合物 C.在碳中和研究中,選擇合適的催化劑將CO2氧化為甲酸等液體燃料 D.我國(guó)自主研發(fā)的“東方超環(huán)”(人造太陽(yáng))所應(yīng)用的氕、氘、氚互為同位素 組卷:10引用:2難度:0.8 -
2.設(shè)NA為阿伏加德羅常數(shù)的值,下列敘述正確的是( )
A.0.5mol苯中含有碳碳雙鍵的數(shù)目為1.5NA B.20g重水(D2O)中含有的質(zhì)子數(shù)目為10NA C.標(biāo)準(zhǔn)狀況下,11.2L己烷中含有的分子數(shù)為0.5NA D.常溫下,5.6g鐵粉與足量濃硝酸反應(yīng),轉(zhuǎn)移的電子數(shù)為0.3NA 組卷:10引用:2難度:0.7 -
3.下列性質(zhì)的比較,強(qiáng)弱關(guān)系正確且能用元素周期律解釋的是( )
A.酸性:HClO4>H2SO3>H2SiO3 B.堿性:NaOH<Mg(OH)2<Al(OH)3 C.熱穩(wěn)定性:H2O>H2S>PH3 D.沸點(diǎn):NH3<HF<H2O 組卷:26引用:2難度:0.7 -
4.拉希法制備肼(N2H4)的主要反應(yīng)為NaClO+2NH3═NaCl+N2H4+H2O.下列表示反應(yīng)中相關(guān)微粒的化學(xué)用語(yǔ)正確的是( )
A.中子數(shù)為18的氯原子: Cl3518B.N2H4的電子式: 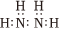
C.NH3的空間充填模型: 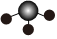
D.Cl的原子結(jié)構(gòu)示意圖: 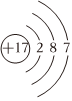 組卷:14引用:2難度:0.7
組卷:14引用:2難度:0.7 -
5.常溫下,下列各組離子在指定溶液中一定能大量共存的是( )
A.0.1mol/L碳酸氫鈉溶液中:Na+、Fe3+、NO3-、SO42- B.能使甲基橙變紅的透明溶液中:SO42-、Mg2+、Cu2+、Cl- C.水電離的c(H+)=1×10-13mol?L-1溶液中:Na+、K+、NO3-、NH4+ D.0.1mol?L-1的FeCl3溶液中:K+、Mg2+、SO42-、SCN- 組卷:26引用:3難度:0.7 -
6.化學(xué)小組進(jìn)行實(shí)驗(yàn),能達(dá)到實(shí)驗(yàn)?zāi)康牡氖牵ā 。?br />
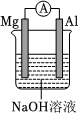
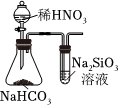
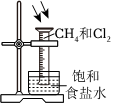
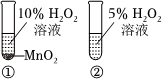
A.比較Mg、Al的活潑性 B.證明非金屬性:N>C>Si C.驗(yàn)證甲烷與氯氣在光照下發(fā)生化學(xué)反應(yīng) D.探究催化劑對(duì)反應(yīng)速率的影響 A.A B.B C.C D.D 組卷:1引用:2難度:0.5
二、非選擇題:本題共4小題,共58分.
-
17.在“碳達(dá)峰、碳中和”的大背景下,實(shí)現(xiàn)CO2的有效轉(zhuǎn)化成為科研工作者的研究熱點(diǎn),以下是幾種常見(jiàn)的CO2利用方法:
Ⅰ.以In2O3作催化劑,可使CO2在溫和條件下轉(zhuǎn)化為甲醇,反應(yīng)經(jīng)歷如下過(guò)程:
ⅰ.催化劑活化:In2O3(無(wú)活性)In2O3-x(有活性);還原氧化
ⅱ.CO2與H2在活化的催化劑表面發(fā)生反應(yīng)①:CO2(g)+3H2(g)?CH3OH(g)+H2O(g) ΔH1,同時(shí)也有反應(yīng)②:CO2(g)+H2(g)?CO(g)+H2O(g) ΔH2等副反應(yīng)發(fā)生.
(1)反應(yīng)①中碳原子的雜化方式變化情況為.
(2)某溫度下,在恒容反應(yīng)器中,能說(shuō)明反應(yīng)①達(dá)到平衡狀態(tài)的是(填序號(hào)).
A.v(H2)=3v(CH3OH)
B.混合氣體的平均摩爾質(zhì)量不變
C.混合氣體的密度不變
D.CH3OH(g)和H2O(g)的分壓相等
(3)某溫度下,CO2與H2的混合氣體以不同流速通過(guò)恒容反應(yīng)器,氣體流速與CO2轉(zhuǎn)化率、CH3OH選擇性的關(guān)系如圖1.(已知:CH3OH選擇性=)CH3OH選擇性隨氣體流速增大而升高的原因可能有:生成CH3OH所消耗CO2的物質(zhì)的量發(fā)生轉(zhuǎn)化的CO2的物質(zhì)的量×100%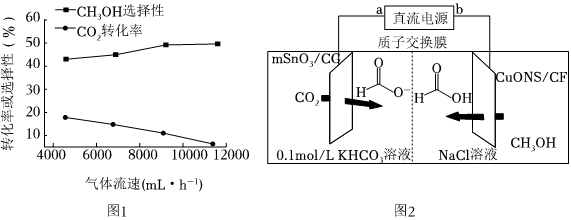
①.
②氣體流速增大可減少產(chǎn)物中H2O(g)的積累,減少催化劑的失活,從而提高CH3OH選擇性,請(qǐng)用化學(xué)方程式表示催化劑失活的原因:.
(4)碳酸氫鹽分解可獲得CO2,在T℃時(shí),將足量的某碳酸氫鹽(MHCO3)固體置于真空恒容容器中,存在如下平衡:2MHCO3M2CO3(s)+H2O(g )+CO2(g).上述反應(yīng)達(dá)平衡時(shí)體系的總壓為p0kPa.保持溫度不變,開(kāi)始時(shí)在體系中先通入一定量的CO2(g),再加入足量MHCO3(s),欲使平衡時(shí)體系中水蒸氣的分壓小于p1kPa,則開(kāi)始時(shí)通入CO2(g)的初始?jí)簭?qiáng)應(yīng)大于△.
Ⅱ.一種以甲醇和二氧化碳為原料,利用活性催化電極,電化學(xué)法制備甲酸(甲酸鹽),其工作原理如圖2所示.
(5)①b極為直流電源的極,寫(xiě)出電解過(guò)程中陰極表面發(fā)生的電極反應(yīng)式:.
②若有1molH+通過(guò)質(zhì)子交換膜時(shí),該裝置內(nèi)生成HCOO-和HCOOH共計(jì)mol.組卷:14引用:2難度:0.5 -
18.化合物G是一種藥物中間體,其合成路線如圖所示:
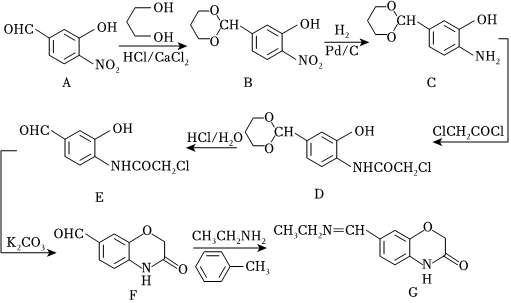
(1)A的分子式為,物質(zhì)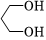 的化學(xué)名稱為 (系統(tǒng)命名法).
的化學(xué)名稱為 (系統(tǒng)命名法).
(2)A→B的反應(yīng)需經(jīng)歷A→X→B的過(guò)程,X的化學(xué)式為C10H13NO6,則推測(cè)X的結(jié)構(gòu)簡(jiǎn)式為.
(3)B→C、C→D的反應(yīng)類型分別為、.
(4)寫(xiě)出E→F反應(yīng)的化學(xué)方程式:.
(5)C有多種同分異構(gòu)體,寫(xiě)出滿足以下要求的同分異構(gòu)體的結(jié)構(gòu)簡(jiǎn)式:(只寫(xiě)一種).
①能與FeCl3溶液發(fā)生顯色反應(yīng);
②核磁共振氫譜顯示四組峰,且峰面積之比為6:3:2:2.
(6)參照題干中的合成路線及信息,以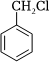 、HOCH2CHO和苯酚為有機(jī)原料制備
、HOCH2CHO和苯酚為有機(jī)原料制備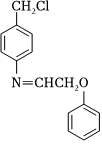 ,設(shè)計(jì)合成路線圖 (無(wú)機(jī)試劑任選,用箭頭表示轉(zhuǎn)化關(guān)系,箭頭上注明試劑和反應(yīng)條件).組卷:5引用:2難度:0.3
,設(shè)計(jì)合成路線圖 (無(wú)機(jī)試劑任選,用箭頭表示轉(zhuǎn)化關(guān)系,箭頭上注明試劑和反應(yīng)條件).組卷:5引用:2難度:0.3


