2023-2024學(xué)年北京理工大學(xué)附中高三(上)月考化學(xué)試卷(10月份)
發(fā)布:2024/9/14 6:0:10
一、選擇題:(每小題只有一個選項符合題意,每小題3分,共42分)
-
1.下列圖示的混合物不屬于膠體的是( )




A.氯化鈉注射液 B.云霧 C.稀豆?jié){ D.煙水晶 A.A B.B C.C D.D 組卷:252引用:5難度:0.8 -
2.下列物質(zhì)的應(yīng)用與氧化還原反應(yīng)無關(guān)的是( )
A.呼吸面具中用過氧化鈉作供氧劑 B.面團(tuán)中加入小蘇打,蒸出的饅頭疏松多孔 C.葡萄糖在人體內(nèi)代謝,可為生命活動提供能量 D.維生素C能促進(jìn)補(bǔ)鐵劑(有效成分FeSO4)的吸收 組卷:34引用:5難度:0.8 -
3.下列化學(xué)用語或圖示表達(dá)正確的是( )
A.N2的結(jié)構(gòu)式:N≡N B.順-2-丁烯的球棍模型: 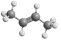
C.CO2的空間填充模型: 
D.基態(tài)N原子的軌道表示式:  組卷:82引用:6難度:0.6
組卷:82引用:6難度:0.6 -
4.下列實驗室制取氣體的方法不合理的是( )
A.鋅粒與稀硫酸反應(yīng)制H2 B.氯化銨受熱分解制NH3 C.電石與飽和食鹽水制C2H2 D.二氧化錳與濃鹽酸共熱制Cl2 組卷:31引用:2難度:0.8 -
5.下列反應(yīng)的離子方程式書寫正確的是( )
A.用Na2S除去廢水中的Hg2+:S2-+Hg2+=HgS↓ B.用FeCl3溶液刻蝕電路板上的銅:Fe3++Cu=Cu2++Fe2+ C.用過量NaOH溶液脫除煙氣中的SO2:OH-+SO2= HSO-3D.海帶灰的浸出液(含有I-)中滴加H2O2得到I2:2I-+H2O2+2H+=I2+O2↑+2H2O 組卷:13引用:1難度:0.6 -
6.某溶液中可能含有Na+、NH4+、Ba2+、SO42-、I-、S2-。分別取樣:①用pH計測試,溶液顯弱酸性;②加氯水和淀粉無明顯現(xiàn)象.為確定該溶液的組成,還需檢驗的離子是( )
A.Na+ B.SO42- C.Ba2+ D.NH4+ 組卷:639引用:70難度:0.7
二、填空題(共58分)
-
18.我國科學(xué)家用粗氫氧化高鈷[Co(OH)3]制備硫酸鈷晶體(CoSO4?7H2O),其工藝流程如下。
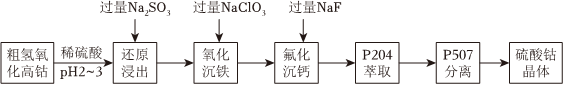
已知:ⅰ.還原浸出液中的陽離子有:Co2+、H+、Fe2+和Ca2+等
ⅱ.部分物質(zhì)的溶度積常數(shù)如下(25℃)
ⅲ.CoSO4?7H2O溶解度隨溫度升高而明顯增大物質(zhì) Ksp CaF2 4.0×10-11 Fe(OH)3, 2.8×10-39
(1)氫氧化高鈷溶于硫酸的化學(xué)方程式是.
(2)浸出Co2+時,理論上氧化性離子和還原性離子物質(zhì)的量之比為.
(3)寫出“氧化沉鐵”的離子方程式;
25℃時,濁液中鐵離子濃度為mol/L((此時pH為4)。
(4)結(jié)合平衡移動原理解釋“氟化沉鈣”步驟加入過量NaF的原因。
(5)P507萃取后,經(jīng)反萃取得到硫酸鈷溶液,將硫酸鈷溶液經(jīng)操作,得到硫酸鈷晶體。
(6)用滴定法測定硫酸鈷晶體中的鈷含量,其原理和操作如下。
在溶液中,用鐵氰化鉀將Co(Ⅱ)氧化為Co(Ⅲ),過量的鐵氰化鉀以Co(Ⅱ)標(biāo)準(zhǔn)液返滴定。反應(yīng)的方程式為:Co2++[Fe(CN)6]3-═Co3++[Fe(CN)6]4-。
已知:鐵氰化鉀標(biāo)準(zhǔn)液濃度為cmol/L,Co(Ⅱ)標(biāo)準(zhǔn)液質(zhì)量濃度為ρg/L。
取mg硫酸鈷晶體,加水配成200mL溶液,取20mL待測液進(jìn)行滴定,消耗V1mL鐵氰化鉀標(biāo)準(zhǔn)液、V2mLCo(Ⅱ)標(biāo)準(zhǔn)液。
計算樣品中鈷含量ω=(以鈷的質(zhì)量分?jǐn)?shù)ω計)。組卷:30引用:2難度:0.5 -
19.某實驗小組對Na2S2O3分別與FeCl3、Fe2(SO4)3的反應(yīng)進(jìn)行實驗探究。
實驗藥品:0.1mol/LNaS2O3溶液(pH=7);0.1mol/LFeCl3溶液(pH=1);
0.05mol/LFe2(SO4)3溶液(pH=1)。
實驗過程
資料:ⅰ.Na2S2O3在酸性條件下不穩(wěn)定,發(fā)生自身氧化還原反應(yīng);實驗編號 Ⅰ Ⅱ Ⅲ 實驗操作 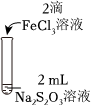
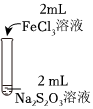
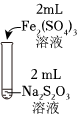
實驗現(xiàn)象 溶液呈紫色,靜置后紫色迅速褪去,久置后出現(xiàn)淡黃色渾濁 溶液呈紫色,靜置后紫色褪去,久置后不出現(xiàn)淡黃色渾濁 溶液呈紫色,靜置后紫色緩慢褪去,久置后不出現(xiàn)淡黃色渾濁
ⅱ.Fe3++S2?Fe(S2O3)+暗紫色,F(xiàn)e2+遇S2O2-3無明顯現(xiàn)象O2-3
(1)配制FeCl3溶液時,需要用鹽酸酸化,結(jié)合離子方程式解釋原因:。
(2)對實驗Ⅰ中現(xiàn)象產(chǎn)生的原因探究如下:
①證明有Fe2+生成:取實驗Ⅰ中褪色后溶液,加入1~2滴K3[Fe(CN)6]溶液,觀察到。
②實驗Ⅰ中紫色褪去時S2被氧化成S4O2-3,相關(guān)反應(yīng)的離子方程式是O2-6。
③實驗Ⅰ和Ⅱ?qū)Ρ龋裰谐霈F(xiàn)淡黃色渾濁,而Ⅱ中不出現(xiàn)淡黃色渾濁的原因是。
(3)為探究實驗Ⅱ和Ⅲ中紫色褪去快慢不同的原因,設(shè)計實驗如下:
①試劑X是實驗編號 Ⅳ Ⅴ 實驗操作 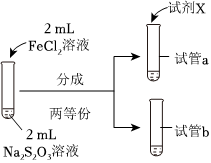
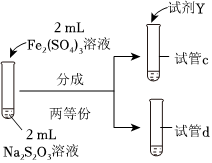
實驗現(xiàn)象 紫色褪去時間a>b 紫色褪去時間c>d 。
②由實驗Ⅳ和實驗Ⅴ得出的結(jié)論是。組卷:40引用:1難度:0.5


