2021-2022學年山東省青島五十八中高二(上)期中化學試卷
發布:2024/4/20 14:35:0
一、選擇題(共15小題,每小題3分,滿分45分)
-
1.下列說法不正確的是( )
A.任何化學反應都伴隨有能量變化 B.化學反應中的能量變化都表現為熱量的變化 C.反應物的總能量高于生成物的總能量時,發生放熱反應 D.反應物的總能量低于生成物的總能量時,發生吸熱反應 組卷:55引用:24難度:0.9 -
2.反應C(s)+H2O(g)?CO(g)+H2(g)在一可變容積的密閉容器中進行,下列條件的改變對其反應速率幾乎無影響的是( )
A.增加C的用量 B.增大反應體系的壓強使體積改變 C.升高體系的反應溫度 D.將容器的體積縮小一半 組卷:12引用:4難度:0.9 -
3.25℃時,下列事實不能說明HF是弱酸的是( )
A.0.1mol?L-1的氫氟酸溶液pH>1 B.升溫,氫氟酸溶液的酸性明顯增強 C.氫氟酸溶液中含有HF分子 D.稀氫氟酸溶液的導電能力弱 組卷:84引用:4難度:0.8 -
4.某溫度下,在容積一定的密閉容器中進行如下反應:2X(g)+Y(g)?Z(g)+W(s)ΔH>0。下列敘述正確的是( )
A.升高溫度,正反應速率增大,逆反應速率減小 B.加入少量W,逆反應速率增大 C.將容器的容積壓縮,可增大單位體積內活化分子的百分數,有效碰撞次數增大 D.向容器中充入氬氣,反應速率不變 組卷:19引用:3難度:0.5 -
5.下列關于用惰性電極電解NaCl溶液的敘述正確的是( )
A.電解時在陽極得到氯氣,在陰極得到金屬鈉 B.若向陽極附近的溶液中滴入KI溶液,溶液呈棕色 C.若向陰極附近的溶液中滴入酚酞溶液,溶液呈無色 D.電解一段時間后,將全部電解液轉移到燒杯中,充分攪拌后溶液呈中性 組卷:7引用:2難度:0.5 -
6.利用下列裝置(夾持裝置略)進行實驗,不能達到實驗目的的是( )
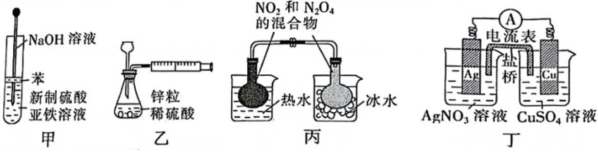
A.利用甲裝置制備Fe(OH)2白色沉淀 B.利用乙裝置測定生成氫氣的速率 C.利用丙裝置探究溫度對化學平衡的影響 D.利用丁裝置設計反應為Cu+2Ag+═Cu2++2Ag的原電池 組卷:2引用:1難度:0.5
二、解答題(共5小題,滿分0分)
-
19.化學反應原理在科學研究和生產生活中有很多應用,請完成下列題目。
(1)一定條件下,不同量的CO2與不同量的NaOH充分反應放出的熱量如表所示:
寫出該條件下CO2與NaOH反應生成NaHCO3的熱化學方程式CO2的量 NaOH的量 放出的熱量 22.0g 750mL.1.0mol/L xkJ 1.0mol 2.0L1.0mol/L ykJ 。
(2)砷酸(H3AsO4)具有較強的氧化性。某實驗小組依據反應AsO43-+2H++2I-═AsO32-+I2+H2O設計如圖原電池,探究pH對AsO43-氧化性的影響,測得電壓與pH的關系如圖所示,a點時,鹽橋中K+移動(填“向左”、“向右”或“不”),c點時,負極的電極反應式為。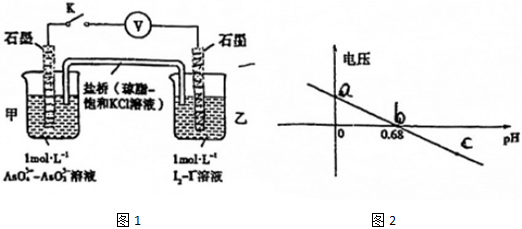
(3)用原電池原理可以除去酸性廢水中的三氯乙烯、AsO3-,其原理如圖3所示(導電殼內部為納米零價鐵)。在除污過程中,納米零價鐵中的Fe為原電池的極(填“正”或“負”),寫出C2HCl3在其表面轉化為乙烷的電極反應式為,當有1molC2HCl3反應時,消耗的Fe為mol。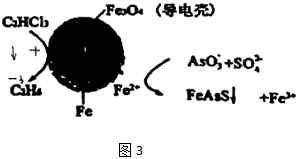 組卷:3引用:1難度:0.7
組卷:3引用:1難度:0.7 -
20.研究并消除氮氧化物污染對建設美麗家鄉,打造宜居環境有重要意義。
(1)已知:①2NO(g)+O2(g)═2NO2(g)ΔH1=-114kJ?mol-1
②C(s)+O2(g)═CO2(g)ΔH2=-393.5kJ?mol-1
③N2(g)+O2(g)═2NO(g)ΔH3=+181kJ?mol-1
若某反應的平衡常數表達式為K=,請寫出此反應的熱化學方程式c(N2)?c2(CO2)c2(NO2)。
(2)T℃時,存在如下平衡:2NO2(g)?N2O4(g)。該反應正逆反應速率與NO2、N2C4的濃度關系為v正=k正c2(NO2),v逆=k逆c(N2O4)(k正、k逆是速率常數),且lgv正~lgc(NO2)與lgv逆~1gc(N2O4)的關系如圖所示。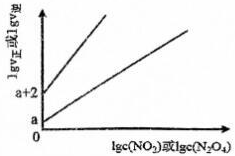
①T℃時,該反應的平衡常數K=。
②T℃時,往剛性容器中充入一定量NO2,平衡后測得c(N2O4)為1.0mol/L,則平衡時NO2的物質的量分數為(以分數表示),平衡后V正=(用含a的表達式表示)。
(3)用活性炭還原法處理氮氧化物的有關反應為C(s)+2NO(g)?N2(g)+CO2(g)。向一恒壓密閉容器中加入一定量(足量)的活性炭和NO,在t2時刻改變某一條件,其反應過程如圖所示。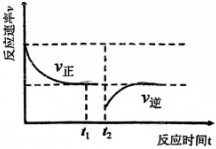
①則t2時刻改變的條件為。
②t1時刻的v逆t2時刻的v正(填“>”“<”或“=”)。
(4)在恒容密閉容器中發生反應2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g)ΔH<0。下列說法正確的是。
A.及時分離出生成的尿素,有利于NH3的轉化率增大
B.反應達到平衡后,混合氣體的密度不再發生改變
C.反應在任何溫度下都能自發進行
D.當尿素的質量不變時,說明反應達到平衡組卷:7引用:1難度:0.5


