2023-2024學年福建省晉江市平山中學、內坑中學、磁灶中學、永春二中、永春中學高二(上)期中化學試卷
發布:2024/10/11 19:0:6
一、選擇題(本大題共10小題,每小題4分,共40分。每小題只有一個選項符合要求。)
-
1.下列關于熱化學反應的描述中正確的是( )
A.已知在一定條件下,N2(g)+3H2(g)?2NH3(g)ΔH=-92.4kJ?mol-1;則將1.5molH2和過量的N2在此條件下充分反應,放出熱量46.2kJ B.反應物的熱效應與是否使用催化劑無關 C.2gH2完全燃燒生成液態水,放熱285.8kJ,則表示氫氣燃燒熱的熱化學方程式為2H2(g)+O2(g)=2H2O(l)ΔH=285.8kJ/mol D.已知稀鹽酸和稀氫氧化鈉溶液反應的中和熱ΔH=-57.3kJ?mol-1,則H2SO4溶液和Ba(OH)2溶液反應的中和熱ΔH=2×(-57.3)kJ?mol-1 組卷:9引用:2難度:0.7 -
2.下列說法正確的是( )
A.恒溫恒壓下,ΔH<0且ΔS>0的反應一定不能自發進行 B.非自發的反應一定可以通過改變條件使其成為自發反應 C.相同物質的量的同種物質氣態時熵值最小,固態時熵值最大 D.反應NH3(g)+HCl(g)=NH4Cl(s)在室溫下可自發進行,則該反應的ΔH<0 組卷:42引用:14難度:0.8 -
3.在生產、生活中,金屬腐蝕會帶來嚴重的經濟損失。下列說法正確的是( )
A.銅腐蝕后生成的銅綠為Cu(OH)2 B.工業上用石墨作電極電解熔融氧化鋁冶煉鋁時,陽極需定期更換 C.鋼鐵發生吸氧腐蝕時,負極反應是Fe-3e-=Fe3+ D.防止鐵管被腐蝕,可以利用電解池原理的犧牲陽極保護法,鐵做陰極被保護 組卷:15引用:1難度:0.7 -
4.某同學按圖甲所示裝置,探究鹽酸與NaOH溶液反應的熱效應,測得燒杯中溶液溫度隨加入a溶液的體積變化關系如圖乙所示(圖甲燒杯中先滴加2滴酚酞試液,溶液呈紅色)。下列說法不正確的是( )

A.隨著a溶液的滴入,燒杯中溶液紅色逐漸變淺直至消失 B.y點對應的溶液中,溶質只有NaCl,而x、z點對應的溶液中,溶質均為兩種 C.利用該反應放熱可以設計成原電池 D.向x、z點對應溶液中分別加入鋁粉,都會有氣泡產生 組卷:15引用:3難度:0.7 -
5.
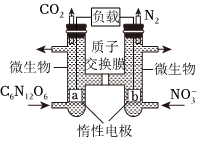 某科研小組設計了一種新型雙微生物燃料電池裝置,如圖所示。在a極將生活污水中的有機物(以C6H12O6為例)轉化為CO2,b極將酸性工業廢水中的硝酸鹽轉化為N2。下列說法不正確的是( )
某科研小組設計了一種新型雙微生物燃料電池裝置,如圖所示。在a極將生活污水中的有機物(以C6H12O6為例)轉化為CO2,b極將酸性工業廢水中的硝酸鹽轉化為N2。下列說法不正確的是( )A.a電極反應式為:C6H12O6-24e-+6H2O=6CO2↑+24H+ B.若b極產生了4.48L(已換算為標準狀況)的氣體,則穿過質子交換膜進入左室的H+數目為2NA C.電池工作時,電流由b極經負載流向a極 D.若用該電池對鉛蓄電池進行充電,b極接PbO2極 組卷:25引用:4難度:0.7
二、填空題(共60分)
-
14.電池的發明和應用是化學家們對人類社會的重要貢獻之一。每一次化學電池技術的突破,都帶來了電子設備革命性的發展。最近,我國在甲烷燃料電池的相關技術上獲得了新突破,原理如圖所示。
 ?
?
(1)甲烷燃料應從口通入(圖1),發生的電極反應式。
(2)以石墨做電極電解Na2SO4溶液,如圖2所示。電解開始后在的周圍(填“陰極”或“陽極”)先出現紅色,該極的電極反應式為。.
(3)以CuSO4溶液為電解質溶液進行粗銅(含Al、Zn、Ag、Pt、Au等雜質)的電解精煉,下列說法正確的是。
A.利用陽極泥可回收Ag、Pt、Au等金屬
B.粗銅接電源正極,發生氧化反應
C.溶液中Cu2+向陽極移動
D.電能全部轉化為化學能
(4)人工腎臟可采用間接電化學方法除去代謝產物中的尿素[CO(NH2)2],原理如圖。
①電源的正極為(填“A”或“B”)。
②電解結束后,陰極室溶液的pH與電解前相比將(填“增大”、“減小”、“不變”);若收集到H22.24L(標準狀況),則通過質子交換膜的H+數目為(忽略氣體的溶解)。組卷:101引用:1難度:0.5 -
15.碳、氮是中學化學重要的非金屬元素,在生產、生活中有廣泛的應用。
(1)治理汽車尾氣中NO和CO的一種方法是:在汽車的排氣管道上安裝一個催化轉化裝置,使NO與CO反應,產物都是空氣中的主要成分。寫出該反應的熱化學方程式。
已知:①N2(g)+O2(g)=2NO(g)ΔH=+179.5kJ/mol
②2NO(g)+O2(g)=2NO2(g)ΔH=-112.3kJ/mol
③NO2(g)+CO(g)=NO(g)+CO2(g)ΔH=-234kJ/mol
(2)N2O5的分解反應2N2O5(g)?4NO2(g)+O2(g),由實驗測得在67℃時N2O5的濃度隨時間的變化如下:
計算在0~2min時段,化學反應速率v(NO2)=時間/min 0 1 2 3 4 5 C(N2O5)/(mol?L-1) 1.00 0.71 0.50 0.35 0.25 0.17 mol?L-1?min-1。
(3)新的研究表明,可以將CO2轉化為炭黑進行回收利用,反應原理如圖所示。
①在轉化過程中起催化作用的物質是;
②寫出總反應的化學方程式。
(4)工業上以NH3和CO2為原料合成尿素[CO(NH2)2),反應的化學方程式如下:
2NH3(g)+CO2(g)?CO(NH2)2(l)+H2O(l),該反應分兩步進行:
①2NH3(g)+CO2(g)?NH4COONH2(s),②NH4COONH2(s)=CO(NH2)2(l)+H2O(l) 根據上述反應,填寫下列空白
①已知該反應可以自發進行,則ΔH0。(填“>”、“<”或“=”);
②一定溫度和壓強下,若原料氣中的NH3和CO2的物質的量之比=x,如圖是x與CO2的平衡轉化率(α)的關系。B點處,NH3的平衡轉化率為n(NH3)n(CO2)。
③一定溫度下,在3L定容密閉容器中充入NH3和CO2,若x=2,當反應后氣體物質的量變為起始時氣體物質的量的時達到平衡,測得此時生成尿素90g。則第①步反應的平衡常數K=23。組卷:4引用:1難度:0.5


