2022-2023學(xué)年遼寧省遼南協(xié)作體高二(上)期中化學(xué)試卷
發(fā)布:2024/10/11 13:0:2
一、單項(xiàng)選擇題(本題共15小題,每小題3分,共45分。每小題只有一個(gè)選項(xiàng)符合要求)
-
1.化學(xué)與生活、生產(chǎn)緊密相關(guān)。下列說法正確的是( )
A.熱的Na2CO3溶液可以去除油污,NH4Cl溶液可以除鐵銹 B.為了防止新冠疫情蔓延,用95%酒精可以更有效殺滅病毒 C.ClO2能殺滅水中的致病菌,其凈水原理與明礬相同 D.高效手性螺環(huán)催化劑通過改變反應(yīng)熱增大化學(xué)反應(yīng)速率 組卷:6引用:3難度:0.7 -
2.下列說法正確的是( )
A.可逆反應(yīng)FeCl3+3KSCN?Fe(SCN)3+3KCl達(dá)到平衡后,加入KCl固體,逆反應(yīng)速率加快 B.中和同pH、同體積的NaOH溶液和氨水,消耗鹽酸中HCl的物質(zhì)的量相同 C.由Sn(s,灰) Sn(s,白)ΔH=+2.1kJ?mol-1可知,灰錫比白錫穩(wěn)定>13.2℃<13.2℃D.NH4Cl溶于D2O的離子方程式:NH4++D2O?NH3?D2O+H+ 組卷:16引用:4難度:0.7 -
3.利用CO2和CH4反應(yīng)制備合成氣( CO、H2)的原理是CH4(g)+CO2(g)?2CO(g)+2H2(g) ΔH>0。溫度為T℃時(shí),該反應(yīng)的平衡常數(shù)為K。下列說法正確的是( )
A.K越大,說明反應(yīng)速率、CO2的平衡轉(zhuǎn)化率越大 B.增大壓強(qiáng),平衡向逆反應(yīng)方向移動(dòng),K減小 C.升高溫度,反應(yīng)速率和平衡常數(shù)K都增大 D.加入催化劑,能提高合成氣的平衡產(chǎn)率 組卷:56引用:4難度:0.6 -
4.常溫下,下列各組離子是因?yàn)榛ハ啻龠M(jìn)水解而不能在溶液大量共存的是( )
A.CrO42-、H+ B.Fe3+、S2- C.AlO2-、HCO3- D.Al3+、CO32- 組卷:5引用:3難度:0.6 -
5.下列實(shí)驗(yàn)方案中,能達(dá)到相應(yīng)實(shí)驗(yàn)?zāi)康牡氖牵ā 。?br />
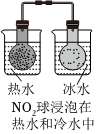
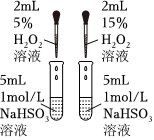
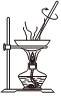
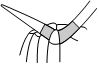
A.研究溫度對(duì)化學(xué)平衡的影響 B.探究濃度對(duì)反應(yīng)速率的影響 C.蒸干AlCl3溶液制無水AlCl3固體 D.堿式滴定管調(diào)液面 A.A B.B C.C D.D 組卷:5引用:3難度:0.6 -
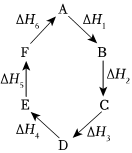 6.物質(zhì)A在一定條件下可發(fā)生一系列轉(zhuǎn)化,由圖判斷下列關(guān)系錯(cuò)誤的是( )
6.物質(zhì)A在一定條件下可發(fā)生一系列轉(zhuǎn)化,由圖判斷下列關(guān)系錯(cuò)誤的是( )A.A→F ΔH=-ΔH6 B.ΔH1+ΔH2+ΔH3+ΔH4+ΔH5+ΔH6=1 C.C→F|ΔH|=|ΔH1+ΔH2+ΔH6| D.|ΔH1+ΔH2+ΔH3|=|ΔH4+ΔH5+ΔH6| 組卷:41引用:4難度:0.8
二、填空題(共55分)
-
18.常溫下,有濃度均為0.1mol?L-1的下列6種溶液:①Na2CO3溶液②NaOH溶液③CH3COONa溶液④NH3?H2O溶液⑤HCl溶液⑥FeCl3溶液
(1)溶液③pH═10的原因是物質(zhì) CH3COOH NH3?H2O HCN H2CO3 H2SO3 電離常數(shù)(Ka) 1.7×10-5 1.7×10-5 4.9×10-10 Ka1═4.3×10-7
Ka2═5.6×10-11Ka1═1.5×10-2
Ka2═1.0×10-7(用離子方程式表示);溶液④pH═11的原因是(用電離方程式表示)
(2)溶液①中各離子濃度由大到小的順序是。
(3)比較等濃度NaCN溶液和CH3COONa溶液的pH值,pH(NaCN)pH(CH3COONa)。
(4)25℃時(shí),V1L⑤溶液和V2L②溶液混合后,混合溶液的pH═12,則V1:V2═。
(5)常溫下,Na2SO3溶液中c(OH-)-c(H+)═c()+HSO-3。
(6)亞磷酸(H3PO3)與足量NaOH溶液反應(yīng)生成Na2HPO3,從分類角度來看,Na2HPO3屬于(選填“酸式鹽”、“正鹽”或“堿式鹽”)。
(7)已知Ksp(AgCl)═1.8×10-10,向50mL0.018mol?L-1AgNO3溶液中加入等體積0.02mol?L-1HCl溶液,混合后溶液中的c(Ag+)═mol?L-1。(設(shè)混合后溶液的體積為原兩溶液體積之和)組卷:10引用:3難度:0.5 -
19.已知反應(yīng)5H2C2O4+2
+6H+=10CO2↑+2Mn2++8H2OMnO-4
(1)小組同學(xué)發(fā)現(xiàn)反應(yīng)速率總是如圖所示,其中t1~t2時(shí)間內(nèi)速率變快的主要原因可能是:①該反應(yīng)放熱②。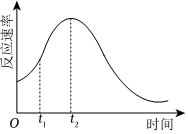
(2)t2后反應(yīng)速率逐漸減小的原因是。
已知:2NO2(g)?N2O4(g)ΔH<0。在恒溫恒容條件下,將一定量NO2和N2O4的混合氣體通入容積為2L的密閉容器中,反應(yīng)過程中各物質(zhì)的物質(zhì)的量濃度c隨時(shí)間t的變化關(guān)系如圖所示。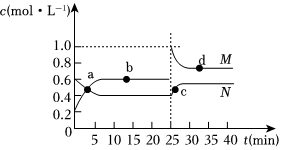
(3)a、b、c、d四個(gè)點(diǎn)中,化學(xué)反應(yīng)處于平衡狀態(tài)的是點(diǎn)。
(4)25min時(shí),增加了(填物質(zhì)的化學(xué)式)mol。
(5)a、b、c、d四個(gè)點(diǎn)所表示的反應(yīng)體系中,氣體顏色由深到淺的順序是(填字母)。
(6)現(xiàn)向恒溫恒壓(0.1MPa)的密閉容器中充入1molA、3molB和6molHe,選擇合適的催化劑使其僅按A(g)+3B(g)?C(g)+D(g)進(jìn)行反應(yīng)。反應(yīng)達(dá)平衡時(shí),測(cè)得A的轉(zhuǎn)化率為20%,則該反應(yīng)的Kp=MPa-2(用平衡分壓代替平衡濃度計(jì)算,分壓=總壓×物質(zhì)的量分?jǐn)?shù),結(jié)果精確到0.1)。若某時(shí)刻該反應(yīng)的Q>K,則此刻V正V逆(填“>”、“<”、“=”)。組卷:8引用:3難度:0.5


