2021-2022學年甘肅省武威市民勤一中高二(上)第一次月考化學試卷
發布:2024/4/20 14:35:0
一、選擇題(每題2.5分,共50分)
-
1.下列與化學反應能量變化相關的敘述正確的是( )
A.根據能量守恒定律,生成物總能量一定等于反應物總能量 B.放熱反應的反應速率一定大于吸熱反應的反應速率 C.應用蓋斯定律,可計算某些難以直接測量的反應焓變 D.同溫同壓下,H2(g)+Cl2(g)═2HCl(g)在光照和點燃條件下的△H不同 組卷:5引用:9難度:0.9 -
2.下列反應中生成物總能量高于反應物總能量的是( )
A.乙醇燃燒 B.灼熱的炭與二氧化碳反應 C.鋁粉與氧化鐵粉末反應 D.實驗室制備氫氣 組卷:1引用:1難度:0.7 -
3.將10mol A和5mol B放入10L真空箱內,某溫度下發生反應:3A(g)+B(g)?2C(g),在最初0.2s內,消耗A的平均速率為0.06mol?(L?s)-1.則在0.2s時,真空箱中C的物質的量是( )
A.0.12 mol B.0.08 mol C.0.04 mol D.0.8 mol 組卷:61引用:10難度:0.7 -
4.全球變暖給人們敲響了警鐘,地球正面臨巨大的挑戰。下列說法不正確的是( )
A.推廣“低碳經濟”,減少溫室氣體的排放 B.推進小火力發電站的興建,緩解地方用電困難,促進地方經濟快速發展 C.推廣“綠色汽油”計劃,吸收空氣中的CO2并利用廉價能源合成汽油 D.利用晶體硅制作的太陽能電池將太陽能直接轉化為電能 組卷:10引用:2難度:0.6 -
5.對于可逆反應A(g)+3B(s)?2C(g)+2D(g),在不同條件下的化學反應速率如下,其中表示的反應速率最快的是( )
A.υ(A)=0.5mol/(L?min) B.υ(B)=1.2mol/(L?s) C.υ(C)=0.1mol/(L?s) D.υ(D)=0.4mol/(L?min) 組卷:54引用:9難度:0.9 -
6.把0.6mol氣體X和0.4 mol氣體Y混合于2.0L的密閉容器中,發生反應:3X(g)+Y(g)?nZ(g)+2W(g),測得5min末已生成0.2mol W,又知以Z表示的平均反應速率為0.01mol?L-1?min-1,則n值是( )
A.1 B.2 C.3 D.4 組卷:86引用:4難度:0.6 -
7.下列說法或表示正確的是( )
A.等量的硫蒸氣和硫固體分別完全燃燒,后者放出熱量多 B.甲烷的燃燒熱ΔH=-890.3 kJ?mol-1,則甲烷燃燒的熱化學方程式可表示為CH4(g)+2O2(g)═CO2(g)+2H2O(l)ΔH=-890.3 kJ?mol-1 C.由C(石墨)=C(金剛石) ΔH=+1.9 kJ?mol-1可知,金剛石比石墨穩定 D.一定條件下,將0.5 mol N2和1.5 mol H2置于密閉容器中充分反應生成NH3放熱19.3 kJ其熱化學方程式為N2(g)+3H2(g)?2NH3(g)ΔH=-38.6 kJ?mol-1 組卷:2引用:1難度:0.5 -
8.有關熱化學方程式書寫與對應表述均正確的是( )
A.稀醋酸與0.1 mol?L-1 NaOH溶液反應:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ?mol-1 B.氫氣的標準燃燒熱為285.5 kJ?mol-1,則水分解的熱化學方程式:2H2O(l)═2H2(g)+O2(g)△H=285.5 kJ?mol-1 C.密閉容器中,9.6 g硫粉與11.2 g鐵粉混合加熱生成硫化亞鐵17.6 g時,放出19.12 kJ熱量. 則Fe(s)+S(s)═FeS(s)△H=-95.6 kJ?mol-1 D.已知2C(s)+O2(g)═2CO(g)△H=-221 kJ?mol-1,則可知C的標準燃燒熱為110.5 kJ?mol-1 組卷:13引用:4難度:0.7
二.填空題(每空2分,共50分)
-
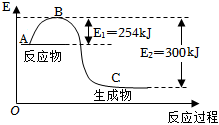 24.氮是地球上含量豐富的一種元素,氮及其化合物在工農業生產、生活中有著重要作用.
24.氮是地球上含量豐富的一種元素,氮及其化合物在工農業生產、生活中有著重要作用.
(1)如圖是N2(g)和H2(g)反應生成1mol NH3(g)過程中能量的變化示意圖,請寫出N2和H2反應的熱化學方程式:.
(2)若已知下列數據:
試根據表中及圖中數據計算N-H的鍵能:化學鍵 H-H N≡N 鍵能/kJ?mol-1 435 943 kJ?mol-1.
(3)用NH3催化還原NOx還可以消除氮氧化物的污染.已知:
4NH3(g)+3O2(g)═2N2+6H2O(g)△H1=-a kJ?mol-1①
N2(g)+O2(g)═2NO(g)△H2=-b kJ?mol-1②
求:若1mol NH3還原NO至N2,則該反應過程中的反應熱△H3=kJ?mol-1(用含a、b的式子表示).
(4)捕碳技術(主要指捕獲CO2)在降低溫室氣體排放中具有重要的作用.目前NH3和(NH4)2CO3已經被用作工業捕碳劑,它們與CO2可發生如下可逆反應:
反應Ⅰ:2NH3(l)+H2O(l)+CO2(g)?(NH4)2CO3(aq)△H1
反應Ⅱ:NH3(l)+H2O(l)+CO2(g)?NH4HCO3(aq)△H2
反應Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g)?2NH4HCO3(aq)△H3
請回答下列問題:
△H3與△H1、△H2之間的關系是△H3=.組卷:21引用:5難度:0.5 -
25.某實驗小組設計用50mL0.50mol?L-1鹽酸和50mL0.55mol?L-1氫氧化鈉溶液在如圖1裝置中進行中和反應,通過測定反應過程中所放出的熱量計算中和熱。
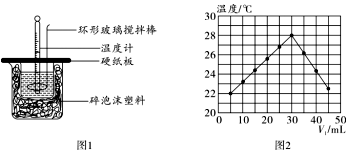
(1)在大小燒杯之間填充碎泡沫塑料的主要作用是。
(2)測定中和熱的過程中至少要使用次溫度計。
(3)假設鹽酸和氫氧化鈉溶液的密度都是1g?cm-3,又知中和反應后生成溶液的比熱容c=4.18J?g-1?℃-1。為了計算中和熱,某學生實驗數據記錄如下表:該實驗測得的中和熱ΔH=kJ?mol-1(結果精確到0.1)。
(4)在中和熱測定實驗中,若用溫度計測定NaOH溶液起始溫度后直接測定鹽酸的溫度,則測得的中和熱數值實驗
序號起始溫度t1/℃ 終止溫度t2/℃ 鹽酸 氫氧化鈉溶液 混合溶液 1 20.0 20.1 23.6 2 20.2 20.4 23.4 3 20.5 20.6 23.6 (填“偏大”“偏小”或“不變”)。
(5)若改用60mL0.50mol?L-1鹽酸和50mL0.55mol?L-1氫氧化鈉溶液進行反應,則與上述實驗相比,所放熱量(填“增加”、“減少”或“不變”,下同),所求中和熱數值。
(6)實驗小組另取V1mL0.50mol?L-1HCl溶液和V2mL未知濃度的NaOH溶液混合均勻后測量并記錄溶液溫度,實驗結果如圖2所示(實驗中始終保持V1+V2=50mL)。則實驗小組做該實驗時的環境溫度(填“高于”“低于”或“等于”)22℃,NaOH溶液的濃度為mol?L-1。組卷:2引用:1難度:0.7


