2021-2022學年福建省福州市格致中學高二(上)期中化學試卷
發布:2024/11/28 16:30:7
一、單選題(本大題共18小題,共36分)
-
1.下列關于強、弱電解質的敘述正確的是( )
A.強電解質溶液的導電能力一定比弱電解質溶液強 B.NH3、CH3COOH、BaSO4、H3PO4都是弱電解質 C.CO2溶于水后能部分電離,故CO2是弱電解質 D.純凈的強電解質在液態時,有的導電,有的不導電 組卷:90引用:4難度:0.8 -
2.以下是常溫下幾種弱酸的電離平衡常數:
下列說法正確的是( )CH3COOH H2S HClO K=1.8×10-5 K1=1.3×10-7K2=7.1×10-15 K=4.69×10-11 A.可發生反應:H2S+2ClO-═S2-+2HClO B.CH3COOH溶液與Na2S溶液不能反應生成NaHS C.H2S的電離平衡常數表達式為:Ka1= c2(H+)?c(S2-)c(H2S)D.同物質的量濃度的H2S、HClO、CH3COOH溶液,酸性最強的是CH3COOH 組卷:12引用:1難度:0.6 -
3.下列不能用平衡移動原理解釋的是( )
A.合成氨時將氨液化分離,可提高原料的利用率 B.H2、I2、HI混合氣體加壓后顏色變深 C.實驗室用排飽和NaCl溶液的方法收集Cl2 D.由NO2和N2O4組成的平衡體系加壓后顏色先變深后變淺 組卷:15引用:2難度:0.7 -
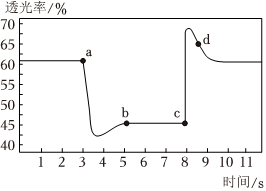 4.已知反應:2NO2(紅棕色)?N2O4(無色)△H<0.將一定量的NO2充入注射器中并密封,改變活塞位置的過程中,氣體透光率隨時間的變化如圖所示(氣體顏色越深,透光率越小).下列說法不正確的是( )
4.已知反應:2NO2(紅棕色)?N2O4(無色)△H<0.將一定量的NO2充入注射器中并密封,改變活塞位置的過程中,氣體透光率隨時間的變化如圖所示(氣體顏色越深,透光率越小).下列說法不正確的是( )A.b點達到平衡狀態 B.b點與a點相比,c(NO2)、c(N2O4)均減小 C.d點:v(正)<v(逆) D.若在c點將溫度降低,其透光率將增大 組卷:208引用:10難度:0.7 -
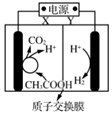 5.某微生物電解池(MEC)制氫工作原理如圖所示。用該電解池電解0.1 mol?L-1的CH3COOH溶液,下列說法正確的是( )
5.某微生物電解池(MEC)制氫工作原理如圖所示。用該電解池電解0.1 mol?L-1的CH3COOH溶液,下列說法正確的是( )A.Y為電源的正極 B.該電解裝置中,陽極的電極反應式為:CH3COOH+2H2O-8e-═2CO2↑+8H+ C.當2 mol H+通過質子交換膜時,產生22.4 L H2 D.電解一段時間后,溶液中 的值變小c(CH3COO-)c(CH3COOH)組卷:88引用:8難度:0.7 -
6.下列說法正確的是( )
A.CO(g)的燃燒熱:ΔH=-283.0kJ/mol,則2CO2(g)=2CO(g)+O2(g)反應的ΔH=-556.0kJ/mol B.已知NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)ΔH=-57.30kJ/mol,則含40.0gNaOH的稀溶液與稀醋酸完全中和,放出57.3kJ的熱量 C.已知2C(s)+2O2(g)=2CO2(g)ΔH=akJ/mol;2C(s)+O2(g)=2CO(g);ΔH=bkJ/mol,則a<b D.已知c(石墨,s)=C(金剛石,s)ΔH>0,則金剛石比石墨穩定 組卷:7引用:1難度:0.5 -
7.用電滲析法可將含硝酸鈉的廢水再生為硝酸和氫氧化鈉,其裝置如圖所示。下列敘述不正確的是( )
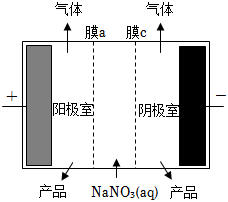
A.膜a、膜c分別是陰離子交換膜、陽離子交換膜 B.陽極室、陰極室的產品分別是氫氧化鈉、硝酸 C.陽極的電極反應式為2H2O-4e-=4H++O2↑ D.該裝置工作時,電路中每轉移0.2 mol 電子,兩極共生成氣體3.36L(標準狀況) 組卷:98引用:5難度:0.7
二、填空題(本大題共4小題,總分64分)
-
21.(1)二氧化氯(ClO2)為一種黃綠色氣體,是國際上公認的高效、廣譜、快速、安全的殺菌消毒劑.如圖1是目前已開發出用電解法制取ClO2的新工藝。
①陽極產生ClO2的電極反應式:。
②當陰極產生標準狀況下112mL氣體時,通過陽離子交換膜離子的物質的量為。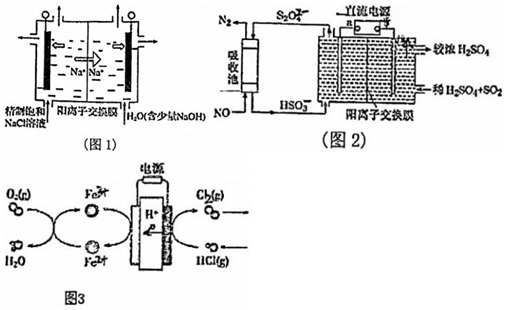
(2)SO2和NOx是主要大氣污染物,利用如圖2裝置可同時吸收SO7和NO。
①已知電解池的陰極室中溶液的pH在4~7之間,陰極的電極反應為。
②用離子方程式表示吸收NO的原理。
(3)在傳統的電解氯化氫回收氯氣技術的基礎上,科學家最近采用碳基電極材料設計了一種新的工藝方案,主要包括電化學過程和化學過程,如圖3所示,陰極區的電極和溶液發生的反應分別是(寫反應方程式)。組卷:9引用:1難度:0.6 -
22.“綠水青山就是金山銀山”,近年來,綠色發展、生態保護成為中國展示給世界的一張新“名片”。汽車尾氣是造成大氣污染的重要原因之一,減少氮的氧化物在大氣中的排放是環境保護的重要內容之一。回答下列問題:
(1)已知:N2(g)+O2(g)=2NO(g)△H=+180.5 kJ/mol
C(s)+O2(g)=CO2(g)△H2=-393.5 kJ/mol
2C(s)+O2(g)=2CO(g)△H3=-221kJ/mol
若某反應的平衡常數表達式為:K=[c(N2)?c2(CO2)]/[c2(NO)?c2(CO)],則此反應的熱化學方程式。
(2)N2O5在一定條件下可發生分解:2N2O5(g)?4NO2(g)+O2(g),某溫度下恒容密閉容器中加入一定量N2O5,測得N2O5濃度隨時間的變化如表:
①反應開始時體系壓強為p0,第2 min時體系壓強為p1,則p1:p0=t/min 0 1 2 3 4 5 c(N2O5)/<mol?L-1) 1.00 0.71 0.50 0.35 0.25 0.17 。
②一定溫度下,在恒容密閉容器中充入一定量N2O5進行該反應,能判斷反應已達到化學平衡狀態
的是(填字母)。
a.NO2和O2的濃度比保持不變 b.容器中壓強不再變化
c.2v正(NO2)=v 逆(N2O5) d.氣體的密度保持不變
(3)Kp是用反應體系中氣體物質的分壓來表示的平衡常數,即將K表達式中平衡濃度用平衡分壓代替。已知反應:NO2(g)+CO(g)?NO(g)+CO2(g),該反應中正反應速率v正=k正?p(NO2)?p(CO),逆反應速率v逆=k逆?p(NO)?p(CO2),其中k正、k逆為速率常數,則Kp為(用k正、k逆表示)。
(4)如圖是密閉反應器中按n(N2):n(H2)=1:3投料后,在200℃、400℃、600℃下,合成NH3反應達到平衡時,混合物中NH3的物質的量分數隨壓強的變化曲線,已知該反應為放熱反應。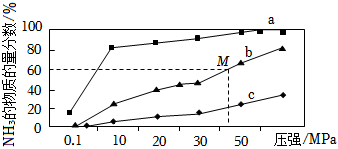
①曲線a對應的溫度是。
②M點對應的H2的轉化率是。組卷:27引用:7難度:0.5


