2023-2024學年廣東省深圳第三高級中學高二(上)期中化學試卷
發布:2024/9/28 0:0:2
一、選擇題:本題共16小題,共44分。第1~10小題,每小題2分;第11~16小題,每小題2分。在每小題給出的四個選項中,只有一項是符合題目要求的。
-
 1.下列反應的能量變化與圖示相符的是( )
1.下列反應的能量變化與圖示相符的是( )A.CO2通過熾熱的C B.Fe粉溶于稀硫酸 C.NaHCO3溶于鹽酸 D.Ba(OH)2?8H2O與 NH4Cl反應 組卷:31引用:1難度:0.7 -
2.化學與生活密切相關。下列人類所利用的能源中不屬于清潔能源的是( )
A.化石能源 B.潮汐能 C.風能 D.氫能 組卷:15引用:2難度:0.7 -
3.一定條件下,向1L的恒容密閉容器中充入1molN2和3molH2,進行合成氨反應。經3s后測得NH3的濃度為0.6mol?L-1,若NH3的濃度從(0.6mol?L-1增大到1.2mol?L-1,所用的時間可能( )
A.小于3s B.等于3s C.大于3s D.無法判斷 組卷:64引用:2難度:0.8 -
4.對化學概念的正確理解可讓我們對化學的認識更加深刻。下列說法正確的是( )
A.活化分子的碰撞一定能發生反應 B.升高溫度,正、逆反應速率一定增大 C.增大反應物的物質的量,反應速率一定增大 D.平衡后,正、逆反應速率發生變化,平衡一定發生移動 組卷:35引用:1難度:0.7 -
5.
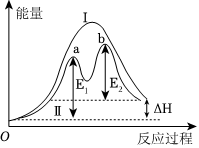 某反應過程的能量變化如圖所示,下列說法正確的是( )
某反應過程的能量變化如圖所示,下列說法正確的是( )A.該反應的ΔH<0 B.該反應需要加熱才能發生 C.反應過程Ⅰ的活化能大于 E1 D.反應過程Ⅱ中步驟b為決速步驟 組卷:16引用:1難度:0.7 -
6.在四種不同條件下,分別進行反應2M(g)+3N(g)═4P(g)+Q(g),實驗測得反應速率分別為(①v(M)═0.20mol?L-1?min-1、②v(N)═0.45mol?L-1?min-1、③v(P)═0.40mol?L-1?min-1、④v(Q)=0.01mol?L-1?s-1。下列關于四種條件下的反應速率大小關系的判斷正確的是( )
A.②>①>③>④ B.④>②>③>① C.④>②=①>③ D.④>②>①=③ 組卷:49引用:6難度:0.7
二、非選擇題:本題共4小題,共56分。
-
19.已知:將KI、鹽酸、試劑X和淀粉四種溶液混合,無反應發生。若再加入雙氧水,將發生反應H2O2+2H++2I-=2H2O+I2,且生成的I2立即與試劑X反應而被消耗。一段時間后,試劑X被生成的I2完全消耗。由于溶液中I-繼續被H2O2氧化,生成的I2與淀粉作用,溶液立即變藍。因此,根據試劑X的量、滴入雙氧水至溶液變藍所需時間,即可推算反應H2O2+2H++2I-=2H2O+I2的反應速率。某同學依據上述原理設計實驗,實驗記錄如下表所示:
回答下列問題:編號 往燒杯中加入的試劑及其用量/mL 溫度/℃ 溶液變藍所需時間/s 0.1mol?L-1KI溶液 H2O 0.01mol?L-1X溶液 0.1mol?L-1雙氧水 0.1mol?L-1稀鹽酸 1 20.0 10.0 10.0 20.0 20.0 20 120 2 20.0 20.0 10.0 V 20.0 20 240 3 20.0 10.0 10.0 20.0 20.0 30 40 4 10.0 20.0 10.0 20.0 20.0 T 80
(1)實驗1和2的目的是探究H2O2濃度對反應速率的影響,則V=;實驗3和4的目的是探究KI濃度對反應速率的影響,則T=。
(2)探究溫度對反應速率的影響的實驗組合為實驗和。由題中數據可知,溫度由20℃升高到30℃,反應速率增大為原來的倍。
(3)若一定溫度下,反應H2O2+2H++2I-=2H2O+I2的速率方程可以表示為v=k?c?(H2O2)?c?(I-)?c(H+)(k為反應速率常數),化學反應的速率方程中各物質濃度的指數稱為各物質的分級數,所有指數的總和稱為反應總級數。請根據上表數據計算,a=,b=,反應總級數為。組卷:16引用:1難度:0.5 -
20.太陽能甲烷-水蒸氣重整制氫過程因具有反應物儲量豐富、成本低、產量高等特點而被廣泛采用。制氫過程中發生的反應為CH4(g)+H2O(g)?3H2(g)+CO(g)。
(1)已知:幾種化學鍵的鍵能(鍵能為1mol氣態分子離解成氣態原子所吸收的能量或氣態原子形成1mol氣態分子所釋放的能量)如表。
請計算反應CH4(g)+H2O(g)═3H2(g)+CO(g)的ΔH=化學鍵 C-H O-H H-H C≡0 鍵能/(kJ?mol-1) 413 463 436 1071 kJ?mol-1。
(2)加壓使CH4平衡轉化率降低,但工業生產中仍采用較高的壓強,原因可能為(填一條即可,下同),為彌補加壓帶來的不利因素,可采取的措施為。
(3)T℃下,向2L恒容密閉容器中充入1molCH4(g)和2molH2O(g),發生上述反應,反應過程中總壓強隨時間的變化關系如圖所示。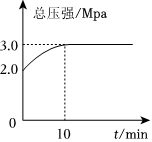
①0~10min內,H2的平均反應速率為mol?L-1?min-1。
②甲烷的平衡轉化率為%。
③Kp為用平衡分壓代替平衡濃度表示的平衡常數(分壓=總壓×物質的量分數),則T℃下該反應的平衡常數Kp為(MPa)2。
④平衡后保持溫度和容積不變,再向容器中充入0.25molCH4(g)和0.25molH2(g),此時v正(填“>”、“<”或“=”)v逆。組卷:19引用:1難度:0.5


