2019年天津市北辰區高考化學二模試卷
發布:2024/12/6 0:0:2
一、選擇題(共6小題,每小題6分,滿分36分)
-
1.化學與生活密切相關。下列說法錯誤的是( )
A.用四氯乙烯干洗劑除去衣服上油污,發生的是物理變化 B.“碳九”(石油煉制中獲取的九個碳原子的芳烴)均屬于苯的同系物 C.蛟龍號潛水器用到鈦合金,22號鈦元素屬于過渡元素 D.波爾多液(硫酸銅、石灰和水配成)用作農藥,利用Cu2+使病毒蛋白變性 組卷:26引用:1難度:0.8 -
2.下列說法正確的是( )
A.電解精煉銅時,若轉移2NA個電子,則陽極減少的質量為64g B.合成氨生產中將NH3液化分離,可加快正反應速率,提高H2的轉化率 C.2Na2O2(s)+2CO2(g)=2Na2CO3(s)+O2(g)在常溫下能自發進行,則該反應的ΔH>0 D.常溫下,KSP[Al(OH)3]=1×10-33.欲使溶液中c(Al3+)≤1×10-6mol?L-1,需調節溶液的pH≥5 組卷:92引用:2難度:0.6 -
 3.BHT是一種常用的食品抗氧化劑。由對甲基苯酚(
3.BHT是一種常用的食品抗氧化劑。由對甲基苯酚( )合成BHT的常用方法有2種(如圖)。下列說法不正確的是( )
)合成BHT的常用方法有2種(如圖)。下列說法不正確的是( )A.BHT能使酸性KMnO4溶液褪色 B.BHT與對甲基苯酚互為同系物 C.BHT中加入濃溴水易發生取代反應 D.方法一的原子利用率高于方法二 組卷:123引用:8難度:0.5
二、解答題(共4小題,滿分64分)
-
9.疊氮化鈉(NaN3)固體易溶于水,微溶于乙醇不溶于乙醚,是汽車安全氣囊中的主要成分,能在發生碰撞的瞬間分解產生大量氣體將氣囊鼓起。
已知NaNH2+N2ONaN3+H2O。210-220℃
實驗室利用如圖裝置模擬工業級NaN3制備。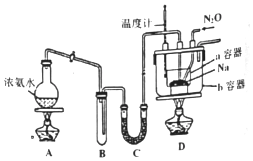
實驗Ⅰ:制備NaN3
(1)裝置C中盛放的藥品為,裝置B的主要作用是。
(2)為了使a容器均勻受熱,裝置D中進行油浴而不用水浴的主要原因是。
(3)氨氣與熔化的鈉反應生成NaNH2的化學方程式為。
(4)N2O可由NH4NO3(熔點169.6℃)在240℃分解制得,應選擇的氣體發生裝置是。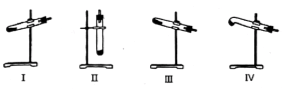
實驗Ⅱ:分離提純
分離提純反應完全結束后,取出裝置D中的混合物進行以下操作,得到NaN3固體。
D中混合物加水Ⅰ加乙醇Ⅱ過濾Ⅲ洗滌ⅣNaN3固體干燥Ⅴ
(5)已知:NaNH2能與水反應生成NaOH和氨氣,操作Ⅳ采用洗滌,其原因是。
實驗Ⅲ:定量測定
實驗室用滴定法測定疊氮化鈉樣品中NaN3的質量分數:
①將2.500g試樣配成500.00mL溶液。
②取50.00mL溶液于錐形瓶中,加入50.00mL 0.1010mol?L-1(NH4)2Ce(NO3)6溶液。
③充分反應后,將溶液稍稀釋,向溶液中加入8mL濃硫酸,滴入3滴鄰菲啰啉指示液,用0.0500mol?L-1(NH4)2Fe(SO4)2標準溶液滴定過量的Ce4+,消耗標準溶液的體積為29.00mL.測定過程中涉及的反應方程式如下:
2(NH4)2Ce(NO3)6+2NaN3═4NH4NO3+2Ce(NO3)3+2NaNO3+3N2↑
Ce4++Fe2+═Ce3++Fe3+
(6)配制疊氮化鈉溶液時,除燒杯、玻璃棒、量筒外,還需要用到的玻璃儀器有。若其它讀數正確,滴定到終點后讀取滴定管中(NH4)2Fe(SO4)2標準溶液體積時俯視,將導致所測定樣品中疊氮化鈉質量分數。(選填“偏大”、“偏小”或“不變”)
(7)試樣中NaN3的質量分數為。(保留四位有效數字)組卷:28引用:1難度:0.5 -
10.消除含氮化合物對大氣和水體的污染是環境保護的重要研究課題。
(1)化學上采用NH3處理NxOy不僅可以消除污染,還可作為工業生產的能量來源。
已知:2NO(g)═N2(g)+O2(g)ΔH=-177kJ/mol
4NH3(g)+3O2(g)═2N2(g)+6H2O(g)ΔH=-1253.4kJ/mol
則用NH3處理NO生成氮氣和氣態水的熱化學方程式為。
(2)已知:N2(g)+3H2(g)?2NH3(g)ΔH<0.不同溫度下,向三個容器中分別投入相同量的反應物進行反應,測得不同壓強下平衡混合物中NH3的物質的量分數如圖1所示。①M點的v正Q點的v正.(填“>”、“<”或“=”)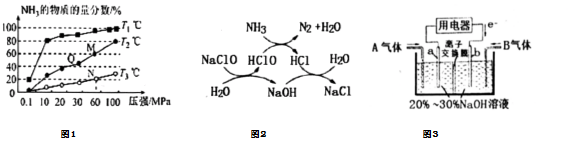
②圖中M點的平衡常數比N點的平衡常數。(填“大”、“小”或“相等”)
(3)水體中過量氨氮(以NH3表示)會導致水體富營養化。
①用次氯酸鈉除去氨氮的原理如圖2所示。寫出總反應化學方程式。
②該反應需控制溫度,溫度過高時氨氮去除率降低的原因是。
(4)氮氧化物也可用堿溶液吸收。若NO和NO2混合氣體被NaOH溶液完全吸收,只生成一種鹽,則該鹽的化學式為;已知常溫下,Ka(HNO2)=5×10-4,則反應HNO2(aq)+NaOH(aq)?NaNO2(aq)+H2O(l)的平衡常數的數值為。
(5)利用反應NO2+NH3→N2+H2O(未配平)消除用電器NO2的簡易裝置如圖3所示。①a電極上的反應式為。
②常溫下,若用該電池電解0.6L飽和食鹽水,一段時間后,測得飽和食鹽水pH變為13,則理論上b電極上消耗B氣體的體積為mL.(標準狀況:假設電解過程中溶液體積不變)組卷:29引用:1難度:0.4


