2021年上海市高考化學等級考模擬試卷(3月份)
發布:2024/4/20 14:35:0
一、選擇題(每小題只有1個正確選項,每小題2分,共40分)
-
1.短周期元素甲、乙、丙、丁的原子序數依次增大,甲和丁的原子核外均有兩個未成對電子,乙、丙、丁最高價氧化物對應的水化物兩兩之間能相互反應。下列說法錯誤的是( )
A.元素丙的單質可用于冶煉金屬 B.甲與丁形成的分子中有非極性分子 C.簡單離子半徑:丁>丙>乙 D.甲與乙形成的化合物可能有氧化性 組卷:32引用:1難度:0.5 -
2.研究表明,氮氧化物和二氧化硫在形成霧霾時與大氣中的氨有關(如圖所示)。下列敘述錯誤的是( )
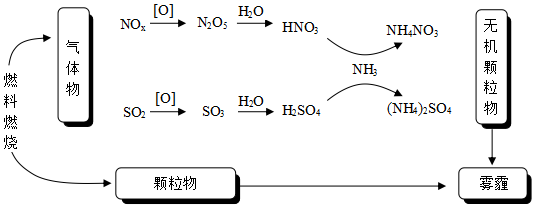
A.NH3是形成無機顆粒物的催化劑 B.霧霾中含有硝酸銨和硫酸銨 C.霧霾可以通過處理利用為化肥 D.霧霾的形成與過度施用氮肥有關 組卷:112引用:2難度:0.5 -
3.NA代表阿伏加德羅常數.已知C2H4和C3H6的混合物的質量為ag,則該混合物( )
A.所含共用電子對數目為 NAa7+1B.所含碳氫鍵數目為 aNA7C.燃燒時消耗的O2一定是 L33.6a14D.所含原子總數為 aNA14組卷:58引用:9難度:0.9 -
4.在NH3、HNO3、H2SO4的工業生產中,具有的共同點是( )
A.使用吸收塔設備 B.使用尾氣吸收裝置 C.使用H2作原料 D.使用催化劑 組卷:76引用:3難度:0.9 -
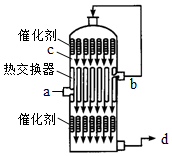 5.在硫酸工業生產中,為了有利于SO2的轉化,且能充分利用熱能,采用了中間有熱交換器的接觸室(見圖).下列說法錯誤的是( )
5.在硫酸工業生產中,為了有利于SO2的轉化,且能充分利用熱能,采用了中間有熱交換器的接觸室(見圖).下列說法錯誤的是( )A.a、b兩處的混合氣體成分含量相同,溫度不同 B.c、d兩處的混合氣體成分含量相同,溫度不同 C.熱交換器的作用是預熱待反應的氣體,冷卻反應后的氣體 D.c處氣體經熱交換后再次催化氧化的目的是提高SO2的轉化率 組卷:909引用:11難度:0.7 -
6.汽車劇烈碰撞時,安全氣囊中發生反應10NaN3+2KNO3═K2O+5Na2O+16N2↑.若氧化產物比還原產物多1.75mol,則下列判斷正確的是( )
A.生成42.0 L N2(標準狀況) B.有0.250 mol KNO3被氧化 C.轉移電子的物質的量為2.5 mol D.被氧化的N原子的物質的量為3.75 mol 組卷:155引用:12難度:0.9 -
7.下列金屬冶煉的反應原理,錯誤的是( )
A.2NaCl(熔融) 2Na+Cl2↑通電B.MgO+H2 Mg+H2O△C.Fe3O4+4CO 3Fe+4CO2高溫D.2HgO 2Hg+O2↑△組卷:332引用:19難度:0.9 -
8.下列實驗操作會導致實驗結果偏高的是( )
A.用NaOH標準液測定未知濃度的鹽酸時,滴定后滴定管尖嘴出現氣泡 B.配制0.1mol?L-1NaCl溶液時,定容時仰視刻度線 C.測定硫酸銅晶體結晶水含量的實驗中,加熱分解后的樣品置于空氣中自然冷卻 D.用鹽酸標準液測定未知濃度的氫氧化鈉溶液時,錐形瓶用待測液潤洗 組卷:22引用:1難度:0.5
二、綜合分析題(共60分)
-
25.沐舒坦(結構簡式為
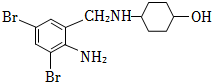 ,不考慮立體異構)是臨床上使用廣泛的。如圖所示的其多條合成路線中的一條(反應試劑和反應條件均未標出)
,不考慮立體異構)是臨床上使用廣泛的。如圖所示的其多條合成路線中的一條(反應試劑和反應條件均未標出)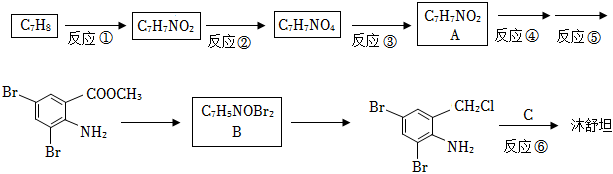
已知: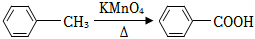
完成下列填空:
(1)寫出反應試劑和反應條件。反應①;反應⑤。
(2)寫出反應類型。反應③;反應⑥。
(3)寫出結構簡式。A;B。
(4)反應⑥中除加入反應試劑C外,還需要加入K2CO3,其目的是中和,。
(5)寫出兩種C的能發生水解反應,且只含3種不同化學環境氫原子的同分異構體的結構簡式。
(6)反應②、反應③的順序不能顛倒,其原因是。
(7)設計以CH3CH2OH和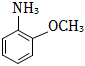 原料制備X(
原料制備X(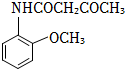 )的合成路線 。(無機試劑任選,合成中須用到下述①②兩條已知信息)
)的合成路線 。(無機試劑任選,合成中須用到下述①②兩條已知信息)
已知信息:
①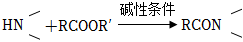 ;
;
②RCH2COOR′+R″CO OR″堿性條件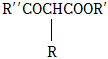 。組卷:38引用:2難度:0.5
。組卷:38引用:2難度:0.5 -
26.甲醛含量的測定有多種方法,例如:在調至中性的亞硫酸鈉溶液中加入甲醛水溶液,經充分反應后,產生的氫氧化鈉的物質的量與甲醛的物質的量相等,然后用已知濃度的硫酸滴定氫氧化鈉。
(1)將4.00mL甲醛水溶液加入到經調至中性的亞硫酸鈉溶液中,充分反應后,用濃度為1.100mol/L的硫酸滴定,至終點時耗用硫酸20.00mL。甲醛水溶液的濃度為mol/L。
(2)上述滴定中,若滴定管規格為50mL,甲醛水溶液取樣不能超過mL。
(3)工業甲醛含量測定的另一種方法:在甲醛水溶液中加入過氧化氫,將甲醛氧化為甲酸,然后用已知濃度的氫氧化鈉溶液滴定。
HCHO+H2O2→HCOOH+H2O
NaOH+HCOOH→HCOON a+H2O
已知H2O2能氧化甲酸生成二氧化碳和水。
如果H2O2用量不足,會導致甲醛含量的測定結果(選填“偏高”、“偏低”或“不受影響”),因為;如果H2O2過量,會導致甲醛含量的測定結果(選填“偏高”、“偏低”或“不受影響”),因為。
(4)甲醛和新制氫氧化銅的反應顯示了甲醛的還原性,發生反應的化學方程式通常表示如下:HCHO+2Cu(OH)2HCOOH+2Cu2O↓+2H2O。若向足量新制氫氧化銅中加入少量甲醛,充分反應,甲醛的氧化產物不是甲酸或甲酸鹽,設計一個簡單實驗驗證這一判斷。△
①主要儀器:試管、酒精燈
②可供選用的試劑:硫酸銅溶液、甲醛、甲酸、氫氧化鈉溶液。
若用容量法測定綠礬中FeSO4?7H2O的含量。滴定反應是:5Fe2++MnO4-+8H+→5Fe3++Mn2++4H2O。
實驗方案如下:
①稱取15.041g綠礬產品,溶解,在250mL容量瓶中定容。
②量取25.00mL待測溶液于錐形瓶中。
③用0.0500mol/L KMnO4溶液(硫酸酸化) 滴定至終點,記錄初讀數和末讀數。
④再重復操作②③1~2次。
⑤數據處理。
(5)潔凈的滴定管在滴定前必須進行的操作有:
①檢驗活塞是否漏水后用蒸餾水潤洗;
②;
③向滴定管中加入KMnO4標液到0刻度以上,趕走尖嘴部位的氣泡,調節初讀數。
某小組同學的實驗數據記錄如下表:
(6)上述樣品中FeSO4?7H2O的質量分數為實驗次數 初讀數(mL) 末讀數(mL) 1 0.20 21.40 2 0.00 21.00 3 1.60 26.60 。(用小數表示,保留三位小數)組卷:29引用:1難度:0.5


