2023年湖南省邵陽一中高考化學(xué)模擬試卷(六)
發(fā)布:2024/4/20 14:35:0
一、選擇題:本題共14小題,每小題3分,共42分。每小題只有一個(gè)選項(xiàng)符合題目要求。
-
1.化學(xué)和生產(chǎn)生活緊密相關(guān),下列敘述錯(cuò)誤的是( )
A.硝酸銨是一種高效氮肥,但受熱或經(jīng)撞擊易發(fā)生爆炸,因此必須作改性處理才能施用 B.加工饅頭、面包和餅干等產(chǎn)品時(shí),加入一些膨松劑(如碳酸氫銨、碳酸氫鈉),可中和酸和受熱分解 C.亞硝酸鈉是一種防腐劑,不能用于任何的食品生產(chǎn)中 D.豆腐是通過豆?jié){加入鹵水而成,其生產(chǎn)過程與膠體性質(zhì)相關(guān) 組卷:97引用:5難度:0.8 -
2.冬季燃煤排放的大量活性溴化合物BrCl能通過光解釋放溴自由基和氯自由基,從而影響大氣中自由基(OH、HO2)的濃度,其循環(huán)原理如圖所示。下列說法不正確的是( )
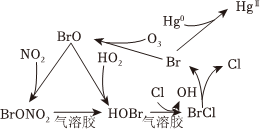
A.NO2的排放會(huì)造成酸雨 B.向原煤中添加石灰石有利于實(shí)現(xiàn)“碳達(dá)峰、碳中和” C.通過上述循環(huán),大氣中OH自由基的濃度升高 D.BrCl的排放會(huì)造成臭氧含量減小 組卷:41引用:4難度:0.6 -
3.已知短周期主族元素R、W、X、Y、Z,其中R元素所在的周期數(shù)是其族序數(shù)的一半,且對(duì)應(yīng)的兩種常見氧化物均為酸性氧化物,W元素與Z元素在同一主族,X與其同主族另一元素單質(zhì)構(gòu)成原子反應(yīng)堆導(dǎo)熱劑,Y元素原子最外層電子數(shù)為m,次外層電子數(shù)為n,Z元素原子L層電子數(shù)為m+n,M層電子數(shù)為m-n,下列敘述中錯(cuò)誤的是( )
A.R、X、Y對(duì)應(yīng)的簡單離子半徑:r(X)<r(Y)<r(R) B.相同溫度相同濃度的R、W、Z的最高價(jià)含氧酸的正鹽溶液的pH:Z>W(wǎng)>R C.將WY2與RY2分別通入Ba(NO3)2溶液中,現(xiàn)象不同 D.因?yàn)閅的氫化物比R的氫化物穩(wěn)定,所以Y的氫化物的熔、沸點(diǎn)比R的氫化物的熔、沸點(diǎn)高 組卷:24引用:3難度:0.6 -
4.有機(jī)化合物丙的一種合成路線如圖所示,下列說法錯(cuò)誤的是( )
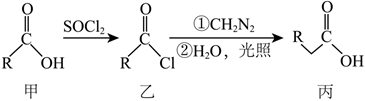
已知:①-R為烴基;
②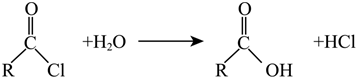 。
。A.若-R為 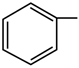 ,則甲的化學(xué)名稱為苯甲酸
,則甲的化學(xué)名稱為苯甲酸B.若-R為—CH3,則甲可與H2發(fā)生加成反應(yīng) C.若-R為—CH2CH3,則丙的同分異構(gòu)體中共有4種酯類物質(zhì)(不考慮立體異構(gòu)) D.1mol甲、乙、丙分別與足量NaOH溶液反應(yīng),消耗NaOH的物質(zhì)的量之比為1:2:1 組卷:39引用:2難度:0.7 -
 5.由相鄰短周期元素W、X、Y、Z組成的穴狀配體結(jié)構(gòu)如圖(部分W和X未標(biāo)注);X、Y、Z同周期,W原子半徑在周期表中最小,下列說法錯(cuò)誤的是( )
5.由相鄰短周期元素W、X、Y、Z組成的穴狀配體結(jié)構(gòu)如圖(部分W和X未標(biāo)注);X、Y、Z同周期,W原子半徑在周期表中最小,下列說法錯(cuò)誤的是( )A.第一電離能:Y>Z>X B.W、X、Y三種元素可形成直線型或平面型化合物 C.X、Y、Z分別與W形成的簡單化合物,其熔沸點(diǎn)在同主族元素中均為最高 D.含W、X、Y、Z元素的化合物,既可以形成分子晶體也可以形成離子晶體 組卷:18引用:2難度:0.5 -
6.2021年諾貝爾化學(xué)獎(jiǎng)授予“不對(duì)稱有機(jī)催化”領(lǐng)域的兩位先驅(qū)者,“不對(duì)稱有機(jī)催化”在新藥合成上具有極為重要的應(yīng)用價(jià)值。某課題組發(fā)現(xiàn)的“不對(duì)稱有機(jī)催化”反應(yīng)的原理為:
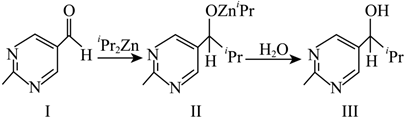
已知:①連有四個(gè)不同原子或基團(tuán)的碳原子稱為手性碳原子;
② 是類似于苯的芳香化合物;iPr表示(CH3)2CH-。
是類似于苯的芳香化合物;iPr表示(CH3)2CH-。
下列說法錯(cuò)誤的是( )A.Ⅰ中不可能所有原子共平面 B.Ⅰ中環(huán)上的一氯代物有2種 C.Ⅱ中有手性碳原子 D.Ⅱ?yàn)棰蟀l(fā)生取代反應(yīng) 組卷:17引用:2難度:0.7
二、非選擇題:本題共4小題,共58分。
-
17.煙道氣和汽車尾氣(NOx、NH3等)是造成霧霾天氣的原因之一。對(duì)這些排放氣的處理以及再利用是化學(xué)工作者研究的重要課題。
(1)H2-SCR脫硝
①氫氣在富氧條件下催化還原NOx反應(yīng)在低溫時(shí)仍具有高活性和選擇性,已知催化劑銠(Rh)表面H2催化還原NO的詳細(xì)反應(yīng)機(jī)理如表所示,其他條件一定時(shí),決定H2催化還原NO反應(yīng)速率的基元反應(yīng)為,基元反應(yīng)OH(s)+Rh(s)→H(s)+O(s)的焓變?chǔ)=kJ?mol-1。
②1093K時(shí),NO與H2以物質(zhì)的量2:1混合,置于某密閉容器中還能發(fā)生如下化學(xué)反應(yīng):2NO(g)+H2(g)═N2O(g)+H2O(g),實(shí)驗(yàn)測(cè)得該反應(yīng)速率方程(以N2O為基準(zhǔn))為v(N2O)=kp2(NO)?p(H2),k=5.6×10-12Pa-2?s-1。某時(shí)刻測(cè)得體系中NO的分壓為2.0kPa,則此時(shí)的反應(yīng)速率為基元反應(yīng) 活化能Ea/(kJ?mol-1) NO+Rh(s)→NO(s)
NO(s)+Rh(s)→N(s)+O(s)
N(s)+N(s)→N2+Rh(s)+Rh(s)
H2+Rh(s)+Rh(s)→H(s)+H(s)
H2O(s)→H2O+Rh(s)
H(s)+H(s)→H2+Rh(s)+Rh(s)
NO(s)→NO+Rh(s)
OH(s)+Rh(s)→H(s)+O(s)
H(s)+O(s)→OH(s)+Rh(s)
OH(s)+H(s)→H2O(s)+Rh(s)0.0
97.5
120.9
12.6
45.0
77.8
108.9
37.7
83.7
33.5Pa-2?s-1。
(2)NH3-SCR脫硝
在有氧和新型催化劑作用下,NOx和NH3可以反應(yīng)生成N2,將一定比例的O2、NOx和NH3通入裝有新型催化劑的反應(yīng)器。測(cè)得相同時(shí)間內(nèi)NOx去除率隨溫度變化如圖所示: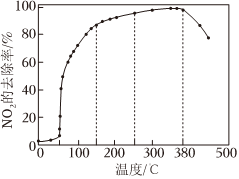
在50~250℃范圍內(nèi),NOx的去除率先快速上升后變緩的主要原因是;380℃后去除率下降的可能原因是。
(3)工業(yè)上可用“氨催化氧化法”生產(chǎn)NO,以氨氣、氧氣為原料,在催化劑存在下生成NO和副產(chǎn)物N2的化學(xué)方程式如下:
Ⅰ.4NH3(g)+5O2(g)═4NO(g)+6H2O(g)
Ⅱ.4NH3(g)+3O2(g)═2N2(g)+6H2O(g)
已知:有效的轉(zhuǎn)化率×100%制備目標(biāo)物質(zhì)消耗原料的量原料總的轉(zhuǎn)化量
在1L恒容密閉容器中充入1molNH3、1.45molO2,在催化劑作用下發(fā)生兩個(gè)競(jìng)爭反應(yīng)Ⅰ、Ⅱ,測(cè)得不同溫度下反應(yīng)相同時(shí)間有關(guān)物質(zhì)的量關(guān)系如圖所示: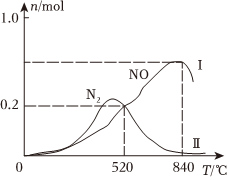
①520℃時(shí),NH3的有效轉(zhuǎn)化率=(保留1位小數(shù))。
②工業(yè)用氨催化氧化制備HNO3,選擇的最佳溫度是。
③520℃時(shí),反應(yīng)Ⅱ的平衡常數(shù)K=(保留3位有效數(shù)字)。組卷:44引用:2難度:0.5 -
18.由C-H鍵構(gòu)建C-C鍵是有機(jī)化學(xué)的熱點(diǎn)研究領(lǐng)域。我國科學(xué)家利用N-苯基甘氨酸中的C-H鍵在O2作用下構(gòu)建C-C鍵,實(shí)現(xiàn)了喹啉并內(nèi)酯的高選擇性制備。合成路線如圖。
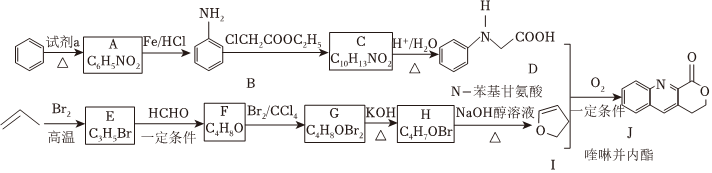
已知:
ⅰ.R-Br+R′CHO一定條件 .
.
ⅱ.ROH+R′BrROR′KOH△
(1)試劑a為。
(2)B具有堿性,B轉(zhuǎn)化為C的反應(yīng)中,使B過量可以提高ClCH2COOC2H5的平衡轉(zhuǎn)化率,其原因是。(寫出一條即可)
(3)C轉(zhuǎn)化為D的化學(xué)方程式為。
(4)G轉(zhuǎn)化為H的化學(xué)方程式為;G生成H的過程中會(huì)得到少量的聚合物,寫出其中一種的結(jié)構(gòu)簡式:。
(5)已知:
ⅰ.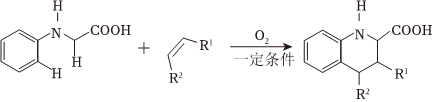
ⅱ.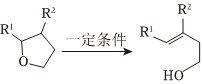
①D和I在O2作用下得到J的4步反應(yīng)如圖(無機(jī)試劑及條件已略去),中間產(chǎn)物1中有兩個(gè)六元環(huán)和一個(gè)五元環(huán),中間產(chǎn)物3中有三個(gè)六元環(huán)。結(jié)合已知反應(yīng)信息,寫出中間產(chǎn)物1和中間產(chǎn)物3的結(jié)構(gòu)簡式、。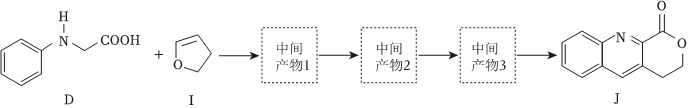
②D和I轉(zhuǎn)化成J的反應(yīng)過程中還生成水,理論上該過程中消耗的O2與生成的J的物質(zhì)的量之比為。組卷:190引用:3難度:0.3


