2021-2022學年重慶市實驗中學高二(上)第二次段考化學試卷
發(fā)布:2024/4/20 14:35:0
一、單選題(共42分)
-
1.下列說法錯誤的是( )
A.水能、風能、生物質(zhì)能是可再生能源,煤、石油、天然氣是不可再生能源 B.“冰,水為之,而寒于水”,說明相同質(zhì)量的水和冰相比較,冰的能量低 C.同溫同壓下,4Al(s)+3O2(g)=2Al2O3(s)在常溫和點燃條件下的ΔH不同 D.反應(yīng)物和生成物具有的總能量的高低,決定了該反應(yīng)是放熱還是吸熱反應(yīng) 組卷:4引用:3難度:0.6 -
2.在載人航天器中,可以利用CO2與H2的反應(yīng),將航天員呼出的CO2轉(zhuǎn)化為H2O等,然后通過電解水得到O2,從而實現(xiàn)O2的再生。已知:
①CO2(g)+4H2(g)=CH4(g)+2H2O(l)ΔH1=xkJ/mol
②2H2O(l)=2H2(g)+O2(g)ΔH2=+571.6kJ/mol
③CH4(g)+2O2(g)=CO2(g)+2H2O(l)ΔH3=-890.3kJ/mol
則x等于( )A.+252.9 B.-252.9 C.+1461.9 D.-318.7 組卷:5引用:2難度:0.7 -
3.中國首條“生態(tài)馬路”在上海復(fù)興路隧道建成,它運用了“光觸媒”技術(shù),在路面涂上一種光催化劑涂料,可將汽車尾氣中45%的NO和CO轉(zhuǎn)化成N2和CO2:2NO(g)+2CO(g)?N2(g)+2CO2(g) ΔH<0,下列對此反應(yīng)的敘述中正確的是( )
A.降低溫度,有效碰撞頻率降低,不利于該反應(yīng)的正向進行 B.增大壓強能使該反應(yīng)的化學平衡常數(shù)K增大 C.NO和CO分子間只要有合理取向的碰撞就能發(fā)生化學反應(yīng) D.使用光催化劑能降低反應(yīng)的活化能,增大活化分子的百分數(shù) 組卷:11引用:2難度:0.5 -
4.下列微粒對一水合氨(NH3?H2O)的電離平衡幾乎不產(chǎn)生影響的是( )
A. 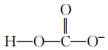
B. 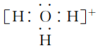
C. 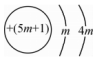
D.13R3+ 組卷:5引用:2難度:0.5 -
5.已知反應(yīng):NH3(g)+HCl(g)═NH4Cl(s)能自發(fā)進行,下列分析正確的是( )
A.反應(yīng)NH3(g)+HCl(g)═NH4Cl(s)是一個熵增的過程 B.反應(yīng)NH3(g)+HCl(g)═NH4Cl(s)可能為吸熱反應(yīng) C.反應(yīng)NH3(g)+HCl(g)═NH4Cl(s)在低溫下可以自發(fā)進行 D.反應(yīng)NH4Cl(s)═NH3(g)+HCl(g)一定不能自發(fā)進行 組卷:38引用:2難度:0.7 -
6.下列說法中正確的是( )
A.冰醋酸加水稀釋過程中,c(H+)逐漸減小 B.室溫下pH=9的NaOH溶液和pH=12的KOH溶液等體積混合,忽略溶液體積變化,混合后溶液的c(H+)約為2.0×10-12mol?L-1 C.室溫下某溶液中水電離出的c(H+)為1×10-10mol?L-1,該溶液的pH一定為10 D.室溫下pH相同的NH4Cl溶液和CH3COOH溶液,由水電離產(chǎn)生的c(H+)相同 組卷:5引用:1難度:0.7
二、非選擇題(共58分)
-
17.酸堿中和滴定是我們常用的一種定量分析方法。
I.為測定某鹽酸的濃度,用已知濃度的氫氧化鈉溶液滴定。
(1)酸式滴定管排氣泡的方法是。
(2)用氫氧化鈉標準溶液滴定,直至,即為滴定終點。
(3)下列操作造成滴定結(jié)果偏高的是。
a.滴定過程中向錐形瓶中加入少量蒸餾水
b.其他操作均正確,滴定終點讀數(shù)時俯視滴定管的刻度
c.未用氫氧化鈉標準溶液潤洗堿式滴定管
d.滴定終點讀數(shù)時發(fā)現(xiàn)滴定管尖嘴處懸掛一滴液體
e.未用待測鹽酸潤洗酸式滴定管
(4)KMnO4常用于氧化還原滴定。滴定時應(yīng)將KMnO4加入滴定管中(填“酸式”或“堿式”)。
(5)高錳酸鉀純度的測定:稱取3.16g高錳酸鉀樣品,溶解后定容于100mL容量瓶中,搖勻。取濃度為0.2000mol/L的H2C2O4標準溶液25.00mL,加入稀硫酸酸化,用高錳酸鉀溶液平行滴定三次,平均消耗的體積為20.00mL,該樣品的純度為(已知2+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O)MnO-4
II.中和熱的測定。
(6)某實驗小組用0.55mol/L的NaOH溶液和0.25mol/L的H2SO4的溶液進行中和熱的測定。取50mLNaOH溶液和50mLH2SO4溶液在中(填儀器名稱)進行實驗。數(shù)據(jù)如下:
近似認為50mL0.55mol/LNaOH溶液和50mL0.25mol/LH2SO4溶液的密度都是1g/mL,中和后生成溶液的比熱容C=4.18J/(g?℃),則測得中和熱ΔH=實驗次數(shù) 起始溫度t1/℃ 終止溫度t2/℃ H2SO4 NaOH 平均值 1 25.2 25.0 25.1 28.5 2 26.2 26.4 26.3 32.5 3 25.3 25.3 25.3 28.8 4 26.1 26.5 26.3 29.6 kJ/mol(精確到小數(shù)點后一位)。組卷:4引用:1難度:0.6 -
18.研究電解質(zhì)在水溶液中的平衡能了解它的存在形式。
(1)已知部分弱酸的電離常數(shù)如下表:
①寫出H2S的Ka1的表達式:弱酸 HF CH3COOH H2CO3 H2S 電離平衡常數(shù)(25℃) Ka=7.2×10-4 Ka=1.75×10-5 K =4.30×10-7a1
K=5.61×10-11a2K =9.1×10-8a1
K=1.1×10-12a2;
②常溫下,濃度相同的三種溶液NaF、Na2CO3、CH3COONa,pH由大到小的順序是;
③將過量H2S通入Na2CO3溶液,反應(yīng)的離子方程式是。
(2)室溫下,用0.100mol?L-1鹽酸溶液滴定20.00mL 0.100mol?L-1的氨水溶液,滴定曲線如圖1所示(忽略溶液體積的變化,①②填“>”、“<”或“=”)。
①a點所示的溶液中c(NH3?H2O)c(Cl-)。
②b點所示的溶液中c(Cl-)c(NH4+)。
③室溫下pH=11的氨水與pH=5的NH4Cl溶液中,由水電離出的c(H+)之比為。
(3)雌黃(As2S3)可轉(zhuǎn)化為用于治療白血病的亞砷酸(H3AsO3)可以用于治療白血病,其在溶液中存在多種微粒形態(tài),各種微粒物質(zhì)的量分數(shù)與溶液的pH關(guān)系如圖2所示。
①人體血液的pH在7.35~7.45之間,用藥后人體中含砷元素的主要微粒是。
②將KOH溶液滴入亞砷酸溶液,當pH調(diào)至11時發(fā)生反應(yīng)的離子方程式是。
③下列說法正確的是(填字母序號)。
a.n(H3AsO3):n(H2AsO3-)=1:1時,溶液顯堿性
b.pH=12時,溶液中c(H2AsO3-)+2c(HAsO32-)+3c(AsO33-)+c(OH-)═c(H+)
c.在K3AsO3溶液中,c(AsO33-)>c(HAsO32-)>c(H2AsO3-)組卷:49引用:3難度:0.4


