2021-2022學年山西省太原五中高二(上)月考化學試卷(12月份)
發布:2024/4/20 14:35:0
一、選擇題(每題只有一個選項符合題意,1~10題每小題2分,11~20題每小題2分)
-
1.化學在日常生活和生產中有著重要的應用。下列說法不正確的是( )
A.明礬水解形成的Al(OH)3膠體能吸附水中懸浮物,可用于水的凈化 B.某雨水樣品采集后放置一段時間,pH由4.68變為4.28是因為溶液中SO32-發生水解 C.將飽和FeCl3溶液滴入沸水中可制備 Fe(OH)3膠體,利用的是鹽類水解的原理 D.醋酸鈉溶液呈堿性的原因是CH3COO-+H2O?CH3COOH+OH- 組卷:4引用:2難度:0.6 -
2.下列說法中錯誤的是( )
A.2CaCO3(s)+2SO2(g)+O2(g)═2CaSO4(s)+2CO2(g)在低溫下能自發進行,則該反應的△H<0 B.NH4Cl(s)═NH3(g)+HCl(g)室溫下不能自發進行,說明該反應的△H>0 C.若△H<0,△S>0,化學反應在任何溫度下都能自發進行 D.加入合適的催化劑能降低反應活化能,從而改變反應的焓變 組卷:35引用:7難度:0.7 -
3.下列方程式書寫正確的是( )
A.NaHSO3在水溶液中的電離方程式:NaHSO3═Na++H++SO32- B.H2C2O4的電離方程式:H2C2O4+H2O?H3O++HC2O4- C.CO32-的水解方程式:CO32-+2H2O?H2CO3+2OH- D.HS-的水解方程式:HS-+H2O?S2-+H3O+ 組卷:27引用:3難度:0.7 -
4.室溫下,下列各組離子在指定溶液中能大量共存的是( )
A.0.1mol/LAlCl3溶液:NH4+、K+、HCO3-、NO3- B.pH=13的溶液:K+、Cu2+、Br-、SO42- C.能使甲基橙變紅的溶液:Ca2+、NH4+、CH3COO-、Cl- D.由水電離產生的c(H+)=1×10-13mol/L的溶液:Na+、K+、Cl-、NO3- 組卷:29引用:4難度:0.7 -
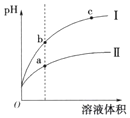 5.某溫度下,pH相同的鹽酸和醋酸溶液分別加水稀釋,兩溶液的pH隨溶液體積變化的曲線如圖所示。據圖判斷,下列說法正確的是( )
5.某溫度下,pH相同的鹽酸和醋酸溶液分別加水稀釋,兩溶液的pH隨溶液體積變化的曲線如圖所示。據圖判斷,下列說法正確的是( )A.Ⅱ為鹽酸稀釋時的pH變化曲線 B.b點溶液的導電性比c點溶液的導電性強 C.a點溶液與b點溶液的導電能力相同 D.b點酸溶液的總濃度大于a點酸溶液的總濃度 組卷:38引用:3難度:0.5 -
6.現有a mol/L NaX和b mol/L NaY兩種鹽溶液.下列說法正確的是( )
A.若a=b且c(X-)=c(Y-)+c(HY),則HX為強酸 B.若a=b且 pH(NaX)>pH(NaY),則c(X-)+c(OH-)>c(Y-)+c(OH-) C.若a>b且c(X-)=c(Y-),則酸性HX>HY D.若兩溶液等體積混合,則c(Na+)=(a+b)mol/L 組卷:21引用:9難度:0.7 -
7.25℃在等體積的①pH=0的H2SO4溶液,②0.05mol?L-1的Ba(OH)2溶液,③pH=10的Na2S溶液,④pH=5的NH4NO3溶液中,由水電離出的c(H+)之比是( )
A.1:10:1010:109 B.1:5:(5×109):(5×108) C.1:20:1010:109 D.1:10:104:109 組卷:189引用:8難度:0.7 -
8.常溫下,濃度均為0.1mol/L的下列溶液中,粒子的物質的量濃度關系正確的是( )
A.氨水中,c(NH4+)=c(OH-)=0.1mol/L B.Na2SO4溶液中,c(Na+)>c(SO42-)>c(OH-)=c(H+) C.NH4Cl溶液中,c(NH4+)>c(Cl-) D.Na2SO3溶液中,c(Na+)=2c(SO32-)+c(HSO3-)+c(H2SO3) 組卷:6引用:1難度:0.7
二、非選擇題
-
25.氨及銨鹽是重要的工業原料,在農業、醫藥、國防和化工等領域有重要應用。
(1)氯化銨作為化肥時不宜與草木灰(主要成分K2CO3)混用,其原因是。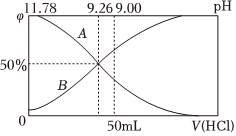
(2)常溫下,向100mL0.2mol/L的氨水中逐滴加入0.2mol/L的鹽酸,所得溶液的pH、溶液中和NH3?H2O物質的量分數與加入鹽酸的體積的關系如圖所示,根據圖象回答下列問題。NH+4
①表示 NH3?H2O濃度變化的曲線是(填“A”或“B”)。
②當加入鹽酸體積為50mL時,溶液中c()-c(NH3?H2O)=NH+4mol/L。(列出計算式即可)
(3)向20mL0.1mol/LNH4HSO4溶液中滴入0.1mol/LNaOH溶液,下列說法正確的是。
A.加入NaOH溶液后,溶液中一定有:c(H+)+c(Na+)+c()═c(OH-)+2c(NH+4)SO2-4
B.當滴入20mLNaOH溶液時:2c()═c(NH3?H2O)+c(SO2-4)NH+4
C.當滴入30mLNaOH溶液時(pH>7):c()>c(NH3?H2O)>c(OH-)>c(H+)NH+4
D.當溶液呈中性時:c()>c(NH+4)>c(Na+)>c(H+)═c(OH-)SO2-4組卷:5引用:1難度:0.7 -
26.過氧化氫是重要的氧化劑、還原劑,它的水溶液又稱為雙氧水,常用作消毒、殺菌、漂白等。
(1)過氧化氫性質探究實驗
已知H2O2是一種二元弱酸,其中Ka1=2.20×10-12、Ka2=1.05×10-25,則H2O2的電離方程式為(只寫第一步電離即可)。
(2)過氧化氫含量的測定實驗
①某興趣小組同學用0.1000mol/L的酸性高錳酸鉀標準溶液滴定試樣中的過氧化氫,離子反應方程式為。
②滴定達到終點的現象是。
③用移液管移取25.00mL試樣置于錐形瓶中,重復滴定四次,每次消耗酸性高錳酸鉀標準溶液的體積如表所示:
計算試樣中過氧化氫的濃度為第一次 第二次 第三次 第四次 V(KMnO4溶液)/mL 17.10 18.10 18.00 17.90 mol/L。
④若滴定前滴定管尖嘴處有氣泡,滴定后消失,則測定結果(填“偏高”“偏低”或“不變”)。組卷:4引用:1難度:0.7


