2022-2023學年河南省洛陽一高高三(上)調研化學試卷(8月份)
發布:2024/4/20 14:35:0
一、選擇題(共16小題,每小題3分,滿分48分)
-
1.化學與生活、科技密切相關。下列說法正確的是( )
A.“殲-20”飛機上使用的碳纖維被譽為“新材料之王”,是一種新型有機高分子材料 B.2020年12月3日,在月球表面成功展開的五星紅旗的主要材料芳綸屬于合成纖維 C.我國海洋開發走向深藍,“蛟龍號”外殼材料使用的鈦合金屬于化合物 D.2020年我國發射的嫦娥5號探月器的太陽能電池帆板的材料是SiO2 組卷:86引用:3難度:0.7 -
2.下列化學用語表示正確的是( )
A.羥基的電子式: 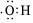
B.鈉離子的結構示意圖: 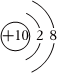
C.氯仿分子的球棍模型: 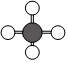
D.對硝基甲苯的結構簡式: 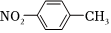 組卷:38引用:3難度:0.7
組卷:38引用:3難度:0.7 -
3.NA表示阿伏加德羅常數的值,下列說法正確的是( )
A.1L 0.1mol?L-1的AlCl3溶液中含有Al3+的數目為0.1NA B.常溫常壓下,2.0g H218O和D2O的混合物中含有的電子數一定為NA C.常溫常壓下,31g白磷燃燒生成P4O6時,斷裂P-P鍵的數目為NA D.0.1mol NaHCO3晶體中陰、陽離子總數為0.3NA 組卷:81引用:2難度:0.6 -
4.利用化學反應可以制取人們需要的物質。下列物質間的轉化均能實現的是( )
A.NaCl(aq) Cl2(g)電解漂白粉(s)石灰水B.Fe3O4 FeCOFeCl3HCl(aq)C.Cl2 Br2NaBr(aq)HBrSO2/H2OD.Mg(OH)2(s) MgCl2(aq)HCl(aq)Mg(s)電解組卷:72引用:3難度:0.6 -
5.下列氣體的制備和性質實驗中,由現象得出的結論錯誤的是( )
選項 試劑 試紙或試液 現象 結論 A 亞硫酸鈉、硫酸 品紅試液 褪色 SO2具有還原性 B 濃鹽酸、濃硫酸 濕潤pH試紙 變紅色 HCl為酸性氣體 C 濃鹽酸、二氧化錳 濕潤淀粉碘化鉀試紙 變藍色 Cl2具有氧化性 D 濃氨水、生石灰 濕潤紅色石蕊試紙 變藍色 NH3為堿性氣體 A.A B.B C.C D.D 組卷:5引用:1難度:0.6 -
6.如圖是某元素M的價類二維圖,其中X是一種強堿,A為正鹽,通常條件下Z是無色液體,D的相對分子質量比E小16,圖中呈現了各物質的轉化關系。下列說法正確的是( )

A.A中只含有離子鍵 B.B物質可以和Y反應直接轉化為E C.D、E均可以用向上排空氣法收集 D.通過氫氧化鈉溶液可以除去D中含有的少量E 組卷:67引用:4難度:0.5 -
7.下列各組離子在給定溶液中能大量共存的是( )
A.在0.1mol?L-1氨水中:Ag+、Cu2+、NO 、SO-32-3B.在0.1mol?L-1氯化鈉溶液中:Fe3+、I-、Ba2+、HCO -3C.在0.1mol?L-1醋酸溶液中:SO 、NH2-4、Br-、H++4D.在0.1mol?L-1硝酸銀溶液中:K+、Cl-、Na+、CO 2-3組卷:951引用:8難度:0.7
二、解答題(共6小題,滿分52分)
-
 21.丙烯是重要的化工原料,通常用丙烷脫氫反應制備。其中丙烷無氧脫氫反應方程式為:CH3CH2CH3(g)?CH3CH=CH2(g)+H2(g) ΔH
21.丙烯是重要的化工原料,通常用丙烷脫氫反應制備。其中丙烷無氧脫氫反應方程式為:CH3CH2CH3(g)?CH3CH=CH2(g)+H2(g) ΔH
(1)科學家將最穩定的單質的標準生成焓規定為零。在溫度為298.15K時由最穩定的單質生成1mol化合物時的焓變,叫做該物質的標準摩爾生成焓。部分物質的標準摩爾生成焓數據如表(單位:kJ?mol-1):
由此可求得ΔH=CH3CH2CH3 CH3CH=CH2 H2 -103.9 20.4 0 kJ?mol-1。
(2)在一定條件下的體積為2L的密閉容器中投入1mol丙烷,體系的起始壓強為p0kPa。反應過程中壓強變化如表:
則反應前6分鐘內用氫氣的濃度表示的反應速率為時間/min 0 2 4 6 8 10 12 14 16 18 壓強/kPa p0 1.2p0 1.36p0 1.50p0 1.63p0 1.71p0 1.78p0 1.80p0 1.80p0 1.80p0 (結果保留兩位有效數據,下同)。此溫度下的壓強平衡常數Kp=。
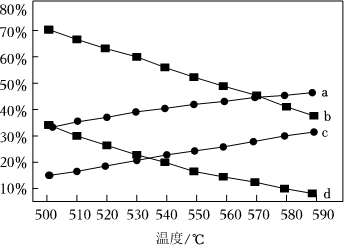
(3)圖中四條線對應的是(2)中在0.01kPa和0.1kPa下丙烷和丙烯在平衡體系中的體積分數隨溫度的變化情況。某同學認為曲線b不可能表示丙烯的體積分數,請寫出兩條支持該觀點的理由:①;②。表示在0.1kPa下丙烯的體積分數的曲線為。
(4)丙烷在有氧氣參與的條件下也可以發生脫氫反應:2CH3CH2CH3(g)+O2(g)?2CH3CH=CH2(g)+2H2O(g) ΔH=-235kJ?mol-1。相比丙烷的無氧脫氫反應,丙烷的有氧脫氫反應的優點可能有、。組卷:10引用:2難度:0.7 -
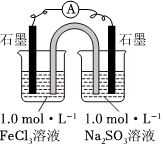 22.某化學興趣小組探究FeCl3溶液和Na2SO3溶液的反應情況。已知:K3[Fe(CN)6]可以和Fe2+生成藍色沉淀,常用于Fe2+的檢驗。請回答相關問題。
22.某化學興趣小組探究FeCl3溶液和Na2SO3溶液的反應情況。已知:K3[Fe(CN)6]可以和Fe2+生成藍色沉淀,常用于Fe2+的檢驗。請回答相關問題。
[實驗1]分別將100mL 1.0mol?L-1的FeCl3溶液和Na2SO3溶液裝入兩個燒杯中,按如圖進行實驗,觀察到電流計指針發生偏轉。
(1)請寫出左側燒杯中的電極反應式。鹽橋中的陽離子向(填“左側”或“右側”)燒杯中遷移。
[實驗2]在試管1中加入2mL1.0mol?L-1Na2SO3溶液,然后再滴加兩滴1.0mol?L-1FeCl3溶液,溶液中立刻變成紅褐色。對試管1進行加熱至沸騰,產生紅褐色沉淀。取出幾滴混合液,加K3[Fe(CN)6]溶液,無藍色沉淀出現。整個過程中未觀察到明顯的氣泡產生。
[實驗3]在試管2中加入5mL1.0mol?L-1FeCl3溶液,然后再滴加1mL1.0mol?L-1 Na2SO3溶液,溶液立刻變成紅褐色。取出幾滴混合液,加K3[Fe(CN)6]溶液,產生藍色沉淀。
(2)實驗3中生成藍色沉淀的離子方程式為。請設計實驗證明被氧化SO2-3。
[反思與研討]
資料顯示:H2SO3的Ka1=1.7×10-2、Ka2=6.0×10-8;Fe(OH)3的Ksp=4×10-38;反應2Fe3+++H2O?2Fe2++SO2-3+2H+的平衡常數K=1020.6。SO2-4
(3)反應2Fe3+++6H2O?2Fe(OH)3↓+3H2SO3的平衡常數K的數量級為SO2-3。由此可判斷FeCl3溶液和Na2SO3溶液發生(填“雙水解”或“氧化還原”)反應的趨勢更大。組卷:13引用:4難度:0.4


