2021-2022學年寧夏永寧中學高二(上)期中化學試卷
發布:2024/4/20 14:35:0
一、單項選擇題(每題2分,共54分)
-
1.下列說法正確的是( )
A.物質發生化學變化不一定都伴隨著能量的變化 B.加入催化劑能改變化學反應的熱效應 C.化學反應的熱效應大部分都是通過實驗測得的 D.H2的燃燒熱ΔH=-285.8kJ/mol,“/mol”指的是每摩爾H2 組卷:2引用:1難度:0.6 -
2.下列過程中△H>0的是( )
A.碳酸鈣受熱分解 B.乙醇燃燒 C.氧化鈣溶于水 D.物質的緩慢氧化 組卷:0引用:1難度:0.7 -
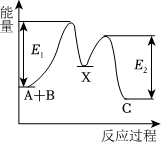 3.反應A+B→C分兩步進行:①A+B→X(慢反應),②X→C(快反應),反應過程中能量變化如圖所示,E1表示反應A+B→X的活化能。下列有關敘述正確的是( )
3.反應A+B→C分兩步進行:①A+B→X(慢反應),②X→C(快反應),反應過程中能量變化如圖所示,E1表示反應A+B→X的活化能。下列有關敘述正確的是( )A.反應A+B→C的ΔH>0 B.X是反應A+B→C的催化劑 C.E2表示反應X→C的活化能 D.反應A+B→C的快慢主要取決于反應① 組卷:3引用:2難度:0.5 -
4.已知N≡N鍵的鍵能是945kJ?mol-1,H-H鍵的鍵能是436kJ?mol-1,N-H鍵的鍵能是391kJ?mol-1,則N2(g)+3H2(g)═2NH3(g)的△H為( )
A.-93kJ/mol B.-208kJ/mol C.+93kJ/mol D.+208kJ/mol 組卷:1引用:2難度:0.5 -
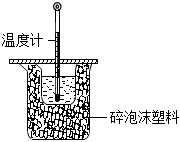 5.實驗室測定中和熱的實驗裝置如圖所示,下列有關說法正確的是( )
5.實驗室測定中和熱的實驗裝置如圖所示,下列有關說法正確的是( )A.燒杯間填滿碎泡沫塑料的作用是固定小燒杯 B.缺少的儀器是環形鐵質攪拌棒 C.測酸液溫度后的溫度計要用水清洗后再測堿液的溫度 D.向盛裝酸的燒杯中加堿時要小心緩慢 組卷:36引用:5難度:0.7 -
6.下列熱化學方程式正確的是( )
選項 已知條件 熱化學方程式 A H2的燃燒熱為akJ?mol-1 H2+Cl2═2HCl ΔH=-akJ?mol-1 B 1molSO2、0.5molO2完全反應后,放出熱量98.3kJ 2SO2(g)+O2(g)?2SO3(g)ΔH=-98.3kJ?mol-1 C H+(aq)+OH-(aq)═H2O(l)
ΔH=-57.3kJ?mol-1H2SO4(aq)+Ba(OH)2(aq)═BaSO4(s)+2H2O(l)ΔH=-114.6kJ?mol-1 D 31g白磷(P4)比31g紅磷(P)能量多bkJ P4(s)=4P(s)ΔH=-4bkJ?mol-1 A.A B.B C.C D.D 組卷:105引用:17難度:0.5 -
7.下列熱化學方程式中△H代表燃燒熱的是( )
A.CH4(g)+ O2(g)═2H2O(l)+CO(g)△H132B.S(s)+ O2(g)═SO3(g)△H232C.C6H12O6(s)+6O2(g)═6CO2(g)+6H2O(l)△H3 D.2CO(g)+O2(g)═2CO2(g)△H4 組卷:21引用:2難度:0.5 -
8.下列圖示關系不正確的是( )
A. 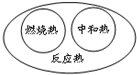
B. 
C. 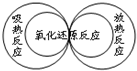
D. 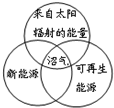 組卷:75引用:13難度:0.9
組卷:75引用:13難度:0.9 -
 9.假設反應體系的始態為甲,中間態為乙,終態為丙,它們之間的變化如圖所示,則下列說法不正確的是( )
9.假設反應體系的始態為甲,中間態為乙,終態為丙,它們之間的變化如圖所示,則下列說法不正確的是( )A.|△H1|一定大于|△H2| B.|△H1|<|△H3| C.ΔH1+ΔH2+ΔH3=0 D.甲→丙過程的ΔH=ΔH1+ΔH2 組卷:55引用:2難度:0.7 -
10.已知:Fe2O3(s)+
C(s)═32CO2(g)+2Fe(s)△H=+234.1kJ/mol32
C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol
則:2Fe(s)+O2(g)═Fe2O3(s)的△H是( )32A.-824.4 kJ/mol B.-627.6 kJ/mol C.-744.7 kJ/mol D.-169.4 kJ/mol 組卷:63引用:24難度:0.9
二、解答題(共3小題,滿分46分)
-
29.(1)室溫下,某溶液中由水電離出的c(H+)=10-12mol?L-1,則該溶液的pH為
。
(2)某溫度下,純水中c(H+)=5.0×10-7mol?L-1,則該溫度下的Kw=,若溫度不變,0.005mol?L-1的H2SO4溶液中,c(H+)=,由水電離出的c(H+)=。
(3)將pH=1的鹽酸稀釋1000倍后,pH為。
(4)將pH=1的CH3COOH溶液稀釋1000倍后,pH的范圍。
(5)25℃時,將0.1mol?L-1NaOH溶液與0.06mol?L-1的H2SO4溶液等體積混合,(忽略混合后體積的變化),求所得溶液的pH為。
(6)將pH=5的H2SO4稀釋1000倍后,c(H+):c(SO42-) 約為。組卷:66引用:2難度:0.6 -
30.合成氨工業在國民生產中有重要意義。關于合成氨的問題,請回答:
(1)若在一容積為2L的密閉容器中加入0.2mol的N2和0.6mol 的H2在一定條件下發生反應:N2(g)+3H2(g)?2NH3(g) ΔH<0,若在5分鐘時反應達到平衡,此時測得 NH3的物質的量為0.2mol。則
(1)平衡時H2的轉化率為。
(2)平衡后,若提高H2的轉化率,可以采取的措施有。
A.加催化劑
B.增大容器體積
C.降低反應體系的溫度
D.加入一定量N2
(3)若在0.5L的密閉容器中,進行如下反應:N2(g)+3H2(g)?2NH3(g) ΔH<0,其化學平衡常數K與溫度T的關系如表所示:請完成下列問題:
寫出化學平衡常數K的表達式T/℃ 200 300 400 K K1 K2 0.5 ;比較K1、K2的大小,K1K2(填“>”“<”或“=”);400℃時,反應2NH3(g)?N2(g)+3H2(g)的化學平衡常數為。400℃當測得NH3、N2和H2物質的量分別為3mol、2mol和1mol時,則該反應的v(N2)正v(N2)逆(填“>”“<”或“=”)。
(4)根據化學反應速率和化學平衡理論,聯系合成氨的生產實際,下列說法不正確的是。
A.化學反應速率理論可指導怎樣在一定時間內快出產品
B.勒夏特列原理可指導怎樣使用有限原料多出產品
C.催化劑的使用是提高產品產率的有效方法
D.正確利用化學反應速率和化學反應限度理論都可以提高化工生產的綜合經濟效益組卷:6引用:2難度:0.6


