2011-2012學年遼寧省大連市瓦房店高級中學高二(下)暑假化學作業(八)
發布:2024/4/20 14:35:0
一、選擇題(包括18小題,每小題3分共54分.每小題只有一個選項符合題意)
-
1.NA表示阿伏加德羅常數的值,下列敘述正確的是( )
A.在1 L 0.2 mol?L-1的Na2CO3溶液中含有CO32-的數目為0.2NA B.0.1 mol Na參加氧化還原反應,轉移的電子數目一定是0.1 NA C.電解精煉銅時,若陰極得到電子數為2NA個,則陽極質量減少64g D.理論上氫氧燃料電池正極消耗11.2 L氣體時,外線路通過電子數為NA 組卷:16引用:3難度:0.5 -
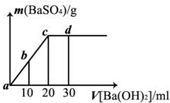 2.常溫下,向0.1mol?L-1的硫酸溶液中逐滴加入物質的量濃度相同的氫氧化鋇溶液,生成沉淀的量與加入氫氧化鋇溶液的體積關系如圖所示,a、b、c、d分別表示實驗時不同階段的溶液,下列有關說法中正確的是( )
2.常溫下,向0.1mol?L-1的硫酸溶液中逐滴加入物質的量濃度相同的氫氧化鋇溶液,生成沉淀的量與加入氫氧化鋇溶液的體積關系如圖所示,a、b、c、d分別表示實驗時不同階段的溶液,下列有關說法中正確的是( )A.溶液的導電能力:a<b<d<c B.溶液的pH:a<b<c<d C.a溶液和b溶液呈堿性 D.d處沉淀的量比c處的大 組卷:26引用:5難度:0.7 -
3.能影響水的電離平衡,并使溶液中的c(H+)>c(OH-)的操作是( )
A.向水中投入一小塊金屬鈉 B.將水加熱煮沸 C.向水中通入二氧化碳氣體 D.向水中加食鹽晶體 組卷:109引用:25難度:0.9 -
4.下列各組離子能在指定溶液中大量共存的是( )
①無色溶液中:K+、Cl-、H2PO4-、PO43-、SO42-
②使pH=14的溶液中:CO32-、Na+、S2-、AlO2-
③室溫下水電離的c(H+)=10-13mol/L的溶液:K+、HCO3-、Br-、Ba2+
④加入Mg能放出H2的溶液中:NH4+、Cl-、Na+、SO42-
⑤使甲基橙變紅的溶液中:MnO4-、NO3-、Na+、Fe3+
⑥室溫下c(H+)/c(OH-)=1012的溶液中:Fe2+、Al3+、NO3-、I-.A.①③ B.②④⑤ C.①②⑤ D.③⑥ 組卷:27引用:12難度:0.9 -
5.已知等濃度HF溶液的酸性比H2SO3溶液的酸性弱,在等濃度NaF和NaHSO3的混合溶液中,下列離子濃度關系正確的是( )
A.c( )>c(F-)>c(OH-)HSO-3B.c(F-)>c( )>c(H+)HSO-3C.c(HF)+c(F-)=c( )+c(H2SO3)HSO-3D.c(Na+)+c(H+)=c( )+c(F-)+c(OH-)HSO-3組卷:15引用:2難度:0.7 -
6.今有室溫下四種溶液,有關敘述不正確的是( )
① ② ③ ④ pH 11 11 3 3 溶液 氨水 氫氧化鈉溶液 醋酸 鹽酸 A.①、②中分別加入適量的氯化銨晶體后,兩溶液的pH均減小 B.分別加水稀釋10倍,四種溶液的pH ①>②>④>③ C.①、④兩溶液等體積混合,所得溶液中c(Cl-)>c(NH4+)>c(OH-)>c(H+) D.VaL④與VbL②溶液混合后,若混合后溶液pH=4,則Va:Vb=11:9 組卷:67引用:30難度:0.7 -
7.常溫下將KOH溶液與HF稀溶液混合,不可能出現的結果是( )
A.pH=7且c(F-)>c(K+)>c(H+)=c(OH-) B.pH<7且c(F-)>c(H+)>c(K+)>c(OH-) C.pH>7且c(K+)+c(H+)=c(F-)+c(OH-) D.pH>7且c(K+)>c(OH-)>c(F-)>c(H+) 組卷:12引用:4難度:0.7
二、非選擇題(本題包括4小題,共46分,)
-
 21.(1)某課外活動小組同學用圖甲裝置進行實驗,試答下列問題:
21.(1)某課外活動小組同學用圖甲裝置進行實驗,試答下列問題:
①若開始時開關K與a連接,則鐵發生電化學腐蝕中的腐蝕.
②若開始時開關K與b連接,則總反應的離子方程式為.
(2)芒硝化學式Na2SO4?l0H2O,無色晶體,易溶于水,是一種分布很廣泛的硫酸鹽礦物.該小組同學設想,如果模擬工業上離子交換膜法制燒堿的方法,用圖乙所示裝置電解硫酸鈉溶液來制取氫氣、氧氣、硫酸和氫氧化鈉,無論從節省能源還是提高原料的利用率而言都更加符合綠色化學理念.
①此時通過陰離子交換膜的離子數(填“大于”“小于”或“等于”)通過陽離子交換膜的離子數.
②制得的氫氧化鈉溶液從出口(填“A”“B”“C”或“D”)導出.
③通電開始后,陰極附近溶液pH會增大,請簡述原因.
④若將制得的氫氣、氧氣和氫氧化鈉溶液組合為氫氧燃料電池,則電池負極的電極反應式為.組卷:16引用:4難度:0.1 -
 22.A、B、C、D、E五種物質(或離子)均含有同一種元素,它們之間有如下轉化關系:
22.A、B、C、D、E五種物質(或離子)均含有同一種元素,它們之間有如下轉化關系:
(1)若A為非金屬單質,C、D的相對分子質量相差16.0.1mol/L E溶液中只有3種離子,且常溫下溶液中的pH=1.A→C的反應中,每轉移1mol e-就會吸熱45kJ,寫出該反應的熱化學方程式:.
(2)若A為金屬單質,B、C均屬于鹽類,D是一種白色沉淀.若B的水溶液呈酸性,C的水溶液呈堿性.寫出C→D反應的離子方程式:.
(3)若A~E均為化合物.A是淡黃色固體;B、C兩溶液在物質的量濃度相等時,C溶液的pH較小.電解D的水溶液是最重要的工業生產之一,D→E→C也是工業制備C的普遍方法.
①電解D的水溶液時,反應的離子方程式為.
②生鐵浸入D溶液而發生銹蝕,正極的電極反應為.組卷:1引用:1難度:0.5


