2021-2022學(xué)年吉林省長(zhǎng)春二中高一(上)第一次月考化學(xué)試卷
發(fā)布:2024/4/20 14:35:0
一、選擇題(每個(gè)題只有一個(gè)正確選項(xiàng),每題2分,共計(jì)52分)
-
1.下列各組物質(zhì)中,第一種是酸,第二種是混合物,第三種是堿的是( )
A.空氣、硫酸銅、硫酸 B.水、空氣、純堿 C.氧化鐵、膽礬、熟石灰 D.硝酸、食鹽水、燒堿 組卷:444引用:56難度:0.9 -
2.磁流體是電子材料的新秀,它既具有固體的磁性,又具有液體的流動(dòng)性。制備時(shí)將含等量FeSO4和Fe2(SO4)3的溶液混合,再滴入稍過(guò)量的NaOH溶液,隨后加入油酸鈉溶液,即可生成黑色的、分散質(zhì)粒子的直徑在5.5~36nm之間的磁流體。下列說(shuō)法中正確的是( )
A.所得的分散系屬于懸濁液 B.該分散系能產(chǎn)生丁達(dá)爾效應(yīng) C.所得的分散系中分散質(zhì)為Fe2O3 D.所得分散系為膠體,且膠粒直徑即為氫氧化鐵分子直徑 組卷:8引用:2難度:0.7 -
3.膠體區(qū)別于其他分散系的本質(zhì)特征是( )
A.光束穿過(guò)膠體時(shí)形成一條光亮的“通路” B.膠體粒子的大小在1~100nm之間 C.膠體粒子可以透過(guò)過(guò)濾紙 D.膠體是一種不穩(wěn)定的體系 組卷:2引用:1難度:0.9 -
4.在某無(wú)色透明的酸性溶液中,能共存的離子組是( )
A.Na+ K+ SO42- HCO3- B.Cu2+ K+ SO42- NO3- C.Na+ K+Cl- NO3- D.Fe3+ K+ SO42- Cl- 組卷:105引用:16難度:0.7 -
5.下列物質(zhì)分類的正確組合是( )
堿 酸 鹽 酸性氧化物 1 純堿 鹽酸 燒堿 二氧化硫 2 燒堿 硫酸 食鹽 一氧化碳 3 苛性鈉 醋酸 石灰石 水 4 苛性鉀 碳酸 蘇打 三氧化硫 A.1 B.2 C.3 D.4 組卷:14引用:2難度:0.9 -
6.下面關(guān)于電解質(zhì)的敘述中錯(cuò)誤的是( )
A.在水溶液中和熔融狀態(tài)下均不導(dǎo)電的化合物叫非電解質(zhì) B.電解質(zhì)、非電解質(zhì)都指化合物而言,單質(zhì)不屬于此范疇 C.電解質(zhì)在水中一定能導(dǎo)電,在水中導(dǎo)電的化合物一定是電解質(zhì) D.純水的導(dǎo)電性很差,但水也是電解質(zhì) 組卷:114引用:13難度:0.9 -
7.下列反應(yīng)既是離子反應(yīng),又是氧化還原反應(yīng)的是( )
A.BaCl2溶液中滴加稀H2SO4 B.鹽酸和氧化鐵反應(yīng) C.鐵片放入CuSO4溶液中 D.氫氣還原CuO 組卷:98引用:15難度:0.7 -
8.觀察如圖并回答問(wèn)題:由圖可知,HCl與NaOH的反應(yīng)實(shí)質(zhì)是H+和OH-之間的反應(yīng),此反應(yīng)可表示為:H++OH-═H2O。像這種用實(shí)際參與反應(yīng)的離子來(lái)表示反應(yīng)的式子稱為離子反應(yīng)方程式。復(fù)分解反應(yīng)大多數(shù)都可用離子反應(yīng)方程式表示。所謂大量共存,就是離子間不相互反應(yīng),如:Ca2+、Cl-就能大量共存。判斷在水溶液中一定能大量共存的離子組是( )
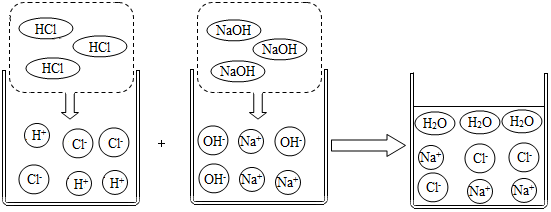
A.Na+、H+、Cl-、CO32- B.H+、Ba2+、Cl-、SO42- C.Cu2+、Na+、NO3-、OH- D.H+、K+、Cl-、SO42- 組卷:0引用:1難度:0.7 -
9.氫化鈉(NaH)可在野外用作生氫劑,其中氫元素為-1價(jià)。NaH用作生氫劑時(shí)的化學(xué)反應(yīng)原理為:NaH+H2O═NaOH+H2↑。下列有關(guān)該反應(yīng)的說(shuō)法中,正確的是( )
A.該反應(yīng)屬于置換反應(yīng) B.該反應(yīng)屬于復(fù)分解反應(yīng) C.NaH是氧化劑 D.H2O中的氫元素被還原 組卷:191引用:18難度:0.7 -
10.在溶液中能大量共存,加入OH-有沉淀析出,加入H+有氣體放出的是( )
A.Na+、Cu2+、Cl-、SO42- B.Fe3+、K+、SO42-、NO3- C.H+、Al3+、OH-、NO3- D.Na+、Ca2+、Cl-、HCO3- 組卷:503引用:44難度:0.9
二、填空題(每空2分,共計(jì)48分。要求寫化學(xué)反應(yīng)方程式的寫成離子反應(yīng)方程式的不給分,要求寫離子反應(yīng)方程式的寫化學(xué)反應(yīng)方程式不給分)【27、28、29、30共計(jì)四題,請(qǐng)把答案認(rèn)真書寫在答題卡上】
-
29.某無(wú)色透明溶液中可能大量存在Ag+、Mg2+、Fe3+、Na+、Cl-、CO32-、OH-和NO3-中的幾種,請(qǐng)?zhí)顚懴铝锌瞻祝?br />(1)不做任何實(shí)驗(yàn)就可以肯定原溶液中不存在的離子是
。
(2)取少量原溶液,加入過(guò)量稀鹽酸,有白色沉淀生成;再加入過(guò)量的稀硝酸,沉淀不消失。說(shuō)明原溶液中肯定存在的離子是,有關(guān)的離子方程式。
(3)取(2)中的濾液,加入過(guò)量的稀氨水(NH3?H2O),出現(xiàn)白色沉淀,說(shuō)明原溶液中肯定有,有關(guān)的離子方程式為。
(4)綜上所述,原溶液中一定存在的離子有,可能存在的離子是。組卷:94引用:11難度:0.5 -
30.按要求寫出下列方程式:
①已知還原性的順序?yàn)镾O32->I->Fe2+>Br->Cl-,請(qǐng)寫出FeBr2與Cl2以3:4的比例反應(yīng)的離子反應(yīng)方程式。
②已知硝酸的氧化性體現(xiàn)在+5價(jià)的N元素上,足量稀硝酸與金屬反應(yīng)會(huì)生成高價(jià)態(tài)的金屬硝酸鹽以及NO。請(qǐng)寫出Cu與HNO3的離子反應(yīng)方程式。
③已知二氧化碳與氫氧化鈉反應(yīng)的生成物與二氧化碳的通入量有關(guān),請(qǐng)寫出生成NaHCO3與Na2CO3的量為1:1的化學(xué)反應(yīng)方程式。組卷:4引用:1難度:0.6


