2021-2022學年浙江省寧波市五校聯考九年級(上)月考科學試卷
發布:2024/4/20 14:35:0
一、選擇題(共15題。60分)
-
1.高氯酸是已知酸中最強的酸.一定溶質質量分數的高氯酸加熱到92℃以上會發生爆炸,其化學方程式為:4HClO4
2Cl2↑+7O2↑+2H2O,該反應的類型屬于( )加熱A.化合反應 B.分解反應 C.復分解反應 D.置換反應 組卷:4引用:2難度:0.5 -
2.下列家用物品中,都用到的材料是( )

A.合成材料 B.天然纖維 C.金屬 D.玻璃 組卷:1引用:1難度:0.5 -
3.復合肥能提供幾種養分,給農作物以“全面呵護”.下列屬于復合肥的是( )
A.硫酸鉀[K2SO4] B.磷酸二氫銨[NH4H2PO4] C.尿素[CO(NH2)2] D.硝酸銨[NH4NO3] 組卷:7引用:1難度:0.5 -
4.物質的性質決定物質的用途,而物質的利用是一把雙刃劍,如不法商販用硫酸銅來浸泡黑木耳,食用這種木耳后,會危害人的身體健康;在游泳池中則通過加入適量的硫酸銅,起到消毒殺菌作用,下列敘述中,錯誤的是( )
A.銅離子可以殺菌,但攝入過多的銅離子會損害人體健康 B.用清水沖洗黑木耳時變成淡藍色,則該黑木耳沒有用硫酸銅浸泡 C.鐵制玩具掉入游泳池中,表面會析出少量紅色物質 D.若服用硫酸銅溶液,可立即飲用大量牛奶,并馬上送醫院診治 組卷:17引用:2難度:0.5 -
5.有甲、乙、丙三種金屬,如果將甲、乙、丙分別投入到CuSO4溶液中,一段時間后,甲、丙表面出現紅色物質,乙沒有明顯現象;再將大小相同的甲、丙分別放到相同的鹽酸中,甲、丙均產生氣泡,但甲產生氣泡的速度明顯快于丙,則甲、乙、丙三種金屬的活動性順序是( )
A.丙>乙>甲 B.甲>丙>乙 C.甲>乙>丙 D.丙>甲>乙 組卷:3引用:1難度:0.5 -
6.化學與生活、生產、科技密不可分,下列敘述正確的是( )
A.合金、塑料、玻璃鋼屬于合成材料 B.用甲醛浸泡過的水產品,可放心食用 C.研制新材料、新能源替代傳統能源,減少污染 D.化肥硝酸銨可與堿性物質混合使用,增大肥效 組卷:0引用:1難度:0.5 -
7.下列各圖中“
 ”“
”“ ”分別表示兩種不同元素的原子,其中表示混合物的是( )
”分別表示兩種不同元素的原子,其中表示混合物的是( )A. 
B. 
C. 
D.  組卷:3引用:1難度:0.5
組卷:3引用:1難度:0.5 -
8.分類法是學習化學的一種方法。下列不屬于分類方法的是( )
A.物質可分為純凈物和混合物,純凈物又可分為單質和化合物 B.有機高分子材料可分為天然有機高分子材料和合成有機高分子材料 C.人體中的元素可分為常量元素和微量元素 D.空氣可分為氮氣、氧氣、稀有氣體、二氧化碳、其他氣體和雜質 組卷:0引用:1難度:0.5 -
9.下列事實不能證明甲的金屬活動性比乙強的是( )
A.自然界中甲元素只以化合物形式存在,乙元素有單質形式存在 B.甲能與鹽酸反應而乙不能 C.甲能從乙的鹽溶液中置換出乙 D.化合物中甲元素顯+2價而乙元素顯+3價 組卷:3引用:1難度:0.5 -
10.電影《黃金大劫案》上映后,里面用“王水”(濃鹽酸與濃硝酸的混合液)溶解黃金的情節引起了廣泛的熱議.黃金溶解在“王水”中形成HAuCl4(四氯合金酸),沒有氫氣產生.根據以上信息,下列有關說法正確的是( )
①“王水”溶解黃金是化學變化;
②金比氫活潑;
③HAuCl4中,Au的化合價為+3價;
④可以將pH試紙伸入“王水”中測其酸堿度;
⑤“王水”可以用鐵質容器盛裝.A.①④⑤ B.①②③ C.③④⑤ D.①③ 組卷:4引用:2難度:0.5 -
11.為提純下列物質,所選用的除雜試劑和分離方法都正確的是( )
序號 物質(括號內為雜質) 除雜試劑 分離方法 A 氯化鈉固體(碳酸鈉) 稀鹽酸 蒸發結晶 B 氯化銅溶液(氯化鋅) 金屬銅 過濾 C 二氧化碳(一氧化碳) 氫氧化鈉溶液 洗氣 D 二氧化錳粉末(碳粉) 水 過濾 A.A B.B C.C D.D 組卷:48引用:4難度:0.5 -
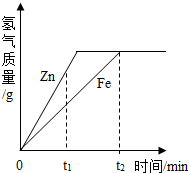 12.一定質量的鋅、鐵分別和等量的鹽酸反應,產生氫氣質量與時間的關系如圖所示,下列說法不正確的是( )
12.一定質量的鋅、鐵分別和等量的鹽酸反應,產生氫氣質量與時間的關系如圖所示,下列說法不正確的是( )A.t1時,產生氫氣的質量鋅比鐵大 B.t1時,產生氫氣的速率鋅比鐵大 C.t2時,參加反應鋅的質量與鐵相同 D.t2時,鋅、鐵消耗的鹽酸質量相同 組卷:55引用:5難度:0.5
四、分析計算題(31題4分,32題5分,33、34、35每題6分,36、37題各8分,共44分)
-
36.定性和定量結合既是化學的重要思想,也是研究物質組成的重要方法。某研究性學習小組為檢測實驗室用H2還原CuO所得紅色固體Cu中是否含有Cu2O(紅色),進行了認真的探究。請你一起踏上探究之路,回答下列問題。
【查閱資料】
①無水CuSO4遇水變藍
②高溫灼燒CuO生成Cu2O和O2
③Cu2O與稀H2SO4反應:Cu2O+H2SO4=Cu+CuSO4+H2O
【設計實驗方案】
方案1 取該紅色固體加入適量稀H2SO4,實驗現象為,結論為紅色固體中含有Cu2O。
方案2 裝置如圖所示,擬通過干燥管中CuSO4變藍來判斷紅色固體是否含有Cu2O。
(1)為確保探究的科學、合理、安全。實驗中還應采取的措施有;(填序號)
①加熱前先排盡裝置中的空氣
②在氫氣發生器與硬質玻璃管之間加一個干燥裝置
③在盛有CuSO4的干燥管后再連接一個裝有濃H2SO4的洗氣瓶
(2)由方案2實驗后得出結論:紅色固體中含有Cu2O.寫出紅色固體Cu2O與H2反應的化學方程式。
方案3 稱得干燥坩堝(常用于固體加熱的容器)的質量為ag,取紅色固體置于坩堝中稱得總質量為bg,在空氣中高溫灼燒至質量恒定,稱得最后坩堝與固體總質量為cg。
(1)該實驗方案最少得進行次稱量;
(2)若確認紅色固體中含有Cu2O,則c與a,b應符合的數學關系式為。組卷:12引用:2難度:0.5 -
37.甲、乙兩個實驗小組分別進行“Na2CO3和NaCl混合物中Na2CO3含量測定”的實驗:

(1)甲組的方法是:將樣品與稀鹽酸反應,測定反應后生成CO2的體積,經換算并計算出樣品中Na2CO3的質量.用圖Ⅰ裝置測定產生的CO2氣體的體積,請分析圖Ⅱ裝置中使反應前后油層上方氣體壓強和外界大氣壓相同操作方法是.
(2)乙組的方法是:取10克樣品,加水溶解后逐漸滴加溶質質量分數為3.65%的稀鹽酸(稀鹽酸的密度取1.0克/毫升),反應過程中不斷攪拌并及時測量滴入鹽酸體積與相應溶液的pH繪表如圖表Ⅲ:結合表中滴入稀鹽酸體積與pH的變化數據,請計算樣品中Na2CO3含量.組卷:8引用:3難度:0.5


