2023-2024學(xué)年北京市豐臺(tái)區(qū)高二(上)期中化學(xué)試卷(A卷)
發(fā)布:2024/10/7 8:0:1
一、選擇題(共42分)本部分共14小題,每小題3分,共42分。在每小題給出的四個(gè)選項(xiàng)中,選出最符合題意的一項(xiàng)
-
1.下列裝置或過程能實(shí)現(xiàn)電能轉(zhuǎn)化為化學(xué)能的是( )
A B C D 



電熱水壺 暖寶寶 新能源汽車充電 風(fēng)力發(fā)電 A.A B.B C.C D.D 組卷:11引用:1難度:0.5 -
2.用90%的普通汽油與10%的燃料乙醇調(diào)和成乙醇汽油,可節(jié)省石油資源。已知乙醇的摩爾燃燒焓為-1366.8kJ?mol-1,下列表示乙醇燃燒反應(yīng)的熱化學(xué)方程式正確的是( )
A.C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l)ΔH=-1366.8kJ?mol-1 B.C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g)ΔH=-1366.8kJ?mol-1 C.C2H5OH(l)+2O2(g)═2CO(g)+3H2O(l)ΔH=-1366.8kJ?mol-1 D.C2H5OH+3O2═2CO2+3H2O ΔH=-1366.8kJ?mol-1 組卷:157引用:8難度:0.5 -
3.在反應(yīng)2HI→H2+I2中,有關(guān)反應(yīng)條件改變使反應(yīng)速率增大的原因分析中,不正確的是( )
A.加入適宜的催化劑,可降低反應(yīng)的活化能 B.增大c(HI),單位體積內(nèi)活化分子數(shù)增大 C.升高溫度,單位時(shí)間內(nèi)有效碰撞次數(shù)增加 D.增大壓強(qiáng),活化分子的百分?jǐn)?shù)增大 組卷:59引用:6難度:0.7 -
4.用鉑電極電解含有下列溶質(zhì)的溶液,電解時(shí)陰極和陽(yáng)極上同時(shí)都有氣體產(chǎn)生,且溶液的pH下降的是( )
A.H2SO4 B.CuSO4 C.HCl D.KCl 組卷:46引用:2難度:0.7 -
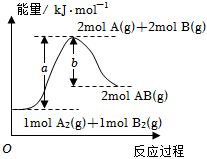 5.反應(yīng)A2(g)+B2(g)═2AB(g)的能量變化示意圖如圖所示。下列說法正確的是( )
5.反應(yīng)A2(g)+B2(g)═2AB(g)的能量變化示意圖如圖所示。下列說法正確的是( )A.1molA2(g)和1molB2(g)的內(nèi)能之和為akJ B.該反應(yīng)每生成2個(gè)AB分子,吸收能量(a-b)kJ C.該反應(yīng)每生成1molAB,放出能量bkJ D.反應(yīng)A2(g)+B2(s)═2AB(g)ΔH=xkJ?mol-1,則x>(a-b) 組卷:187引用:7難度:0.5 -
 6.已知:2H2(g)+O2(g)=2H2O(g)ΔH=-483.6 kJ?mol-1
6.已知:2H2(g)+O2(g)=2H2O(g)ΔH=-483.6 kJ?mol-1
下列說法不正確的是( )A.該反應(yīng)可作為氫氧燃料電池的反應(yīng)原理 B.破壞1 mol H-O 鍵需要的能量是463.4 kJ C.H2O(g)=H2(g)+ O2(g)ΔH=+241.8 kJ?mol-112D.H2(g) 中的H-H 鍵比 H2O(g) 中的H-O 鍵牢固 組卷:55引用:4難度:0.6
二、非選擇題(共58分)
-
18.合成氨對(duì)人類的生存和發(fā)展有著重要意義,1909年哈伯在實(shí)驗(yàn)室中首次利用氮?dú)馀c氫氣反應(yīng)合成氨,實(shí)現(xiàn)了人工固氮。
(1)目前工業(yè)合成氨的主要方法是HaberBosch法:化學(xué)反應(yīng)原理如下:N2(g)+3H2(g)2NH3(g)。400-500℃鐵觸媒:10-30MPa
①該反應(yīng)放熱,但仍選擇較高溫度,原因是。
②理論上,為了增大平衡時(shí)H2的轉(zhuǎn)化率,可采取的措施是(寫出1條)。
③將物質(zhì)的量之比為1:3的N2和H2充入2L的密閉容器中,在一定條件下達(dá)到平衡,測(cè)得平衡時(shí)數(shù)據(jù)如下:
該條件下H2的轉(zhuǎn)化率為物質(zhì) N2 H2 NH3 平衡時(shí)物質(zhì)的量/mol 0.2 0.6 0.2 ,平衡常數(shù)K=(可用分?jǐn)?shù)表示)。
④若按以下濃度投料,其它反應(yīng)條件與③相同,起始時(shí)反應(yīng)進(jìn)行的方向?yàn)?(填“正向”、“逆向”或“無法判斷”)。
(2)電化學(xué)氣敏傳感器可用于檢測(cè)環(huán)境中NH3的含量,其工作原理如圖所示。物質(zhì) N2 H2 NH3 起始濃度(mol?L-1) 0.5 1.5 0.5 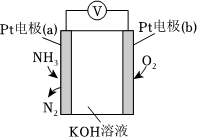
①反應(yīng)消耗的O2與NH3的物質(zhì)的量之比為。
②a極的電極反應(yīng)式為。組卷:4引用:1難度:0.5 -
19.某小組研究Cu2+和Fe3+的氧化性,進(jìn)行如下實(shí)驗(yàn)。

已知:1.(SCN)2是黃色液體,氧化性:I2<(SCN)2<Br2。
2.K3[Fe(CN)6]溶液可用于Fe2+的檢驗(yàn),生成藍(lán)色沉淀。
3.Fe3+與SCN-可以形成多種微粒,例如[Fe(SCN)]2+、Fe(SCN)3等溶液顯紅色。
(1)實(shí)驗(yàn)Ⅰ過程Ⅰ中Cu與FeCl3反應(yīng)的化學(xué)方程式是。
(2)實(shí)驗(yàn)Ⅰ過程Ⅱ中溶液變紅,說明產(chǎn)生了Fe3+,分析可能原因。
假設(shè)①:Fe2+被Cu2+氧化。過程Ⅱ發(fā)生反應(yīng)的電極反應(yīng)式:
a.氧化反應(yīng):Fe2+-e-+3SCN-=Fe(SCN)3
b.還原反應(yīng):。
假設(shè)②:Cu2+和SCN-發(fā)生反應(yīng)生成(SCN)2,進(jìn)而將清液中的Fe2+氧化為Fe3+。設(shè)計(jì)實(shí)驗(yàn)Ⅱ證實(shí)假設(shè)。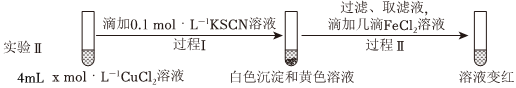
i.x=。
ii.實(shí)驗(yàn)Ⅱ中過程Ⅱ的離子方程式為。
(3)設(shè)計(jì)實(shí)驗(yàn)進(jìn)一步研究Fe3+能否氧化SCN-。
①實(shí)驗(yàn)Ⅲ中加入K3[Fe(CN)6]溶液后,若(寫出實(shí)驗(yàn)現(xiàn)象),說明在該實(shí)驗(yàn)條件下,F(xiàn)e3+未能氧化SCN-。
②進(jìn)一步查閱資料發(fā)現(xiàn):Fe3+與SCN-可以發(fā)生氧化還原反應(yīng)。該小組通過實(shí)驗(yàn)證明了該反應(yīng)的發(fā)生。請(qǐng)你用文字或圖示設(shè)計(jì)實(shí)驗(yàn)方案,并描述相關(guān)的實(shí)驗(yàn)現(xiàn)象:。組卷:4引用:1難度:0.4


