2020-2021學年河北省石家莊市辛集中學高一(下)期中化學試卷
發布:2024/4/20 14:35:0
一、單選題(本題包括30小題,每小題2分,共60分。每小題有一個選項符合題意)
-
1.在密閉系統中有反應C(s)+CO2(g)?2CO(g),能使反應速率加快的措施是( )
①通過減小容器體積增大壓強
②升高溫度
③將炭粉碎
④通入CO2
⑤增加炭的量
⑥恒容條件下通入N2A.①②③⑥ B.①②④⑥ C.①②③④ D.①②③④⑤ 組卷:220引用:30難度:0.7 -
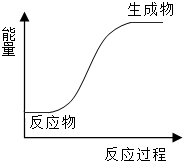 2.下列反應中既是氧化還原反應,能量變化情況又符合如圖的是( )
2.下列反應中既是氧化還原反應,能量變化情況又符合如圖的是( )A.鋁片與稀鹽酸的反應 B.NH4Cl和Ba(OH)2?8H2O的反應 C.灼熱的木炭和水蒸氣反應 D.鈉與水的反應 組卷:15引用:2難度:0.7 -
3.N2和H2在催化劑表面合成氨的微觀歷程及能量變化的示意圖如下,用
 、
、 、
、 分別表示N2、H2、NH3,已知:N2(g)+3H2(g)?2NH3(g),該反應屬于放熱反應。下列說法不正確的是( )
分別表示N2、H2、NH3,已知:N2(g)+3H2(g)?2NH3(g),該反應屬于放熱反應。下列說法不正確的是( )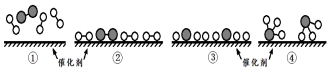
A.②→③過程,是吸熱過程 B.③→④過程,N原子和H原子形成了含有極性鍵的NH3 C.合成氨反應中,反應物斷鍵吸收的能量大于生成物形成新鍵釋放的能量 D.合成氨反應中,反應物總能量大于生成物總能量 組卷:55引用:6難度:0.7 -
4.在研究物質變化時,人們可以從不同的角度、不同的層面來認識物質變化時所引起的化學鍵及能量的變化,據此判斷以下敘述中錯誤的是( )
A.金屬鈉與氯氣反應生成氯化鈉后,其結構的穩定性增強,體系的能量降低 B.物質的燃燒可看成“貯存”在物質內部的部分化學能轉化為熱能釋放出來的過程 C.氮分子內部存在著很強的共價鍵,故通常狀況下氮氣的化學性質很穩定 D.需要加熱才能發生的反應一定是吸熱反應 組卷:22引用:4難度:0.7 -
5.用A、B、C、D四塊金屬片進行如下實驗:據此,判斷四種金屬的活動性順序是( )
①A、B用導線相連后,同時浸入稀H2SO4溶液中,A極為負極
②C、D用導線相連后,同時浸入稀H2SO4溶液中,電流由D→導線→C
③A、C相連后,同時浸入稀H2SO4溶液中,C極產生大量氣泡
④B、D相連后,同時浸入稀H2SO4溶液中,D極逐漸變小A.A>B>C>D B.C>A>B>D C.A>C>D>B D.B>D>C>A 組卷:19引用:2難度:0.5 -
6.下列有關化學反應限度的說法不正確的是( )
A.任何可逆反應的進程都有一定限度 B.化學反應的限度決定了反應物在該條件下轉化為生成物的最大轉化率 C.化學平衡狀態是指一定條件下進行的可逆反應達到的最大限度 D.化學反應的限度不可以通過改變條件而改變 組卷:49引用:4難度:0.6 -
7.NA表示阿伏加德羅常數,下列說法正確的是( )
A.23g NO2和N2O4混合氣體中含有原子總數為1.5NA B.一定條件下,1mol N2與3mol H2充分反應后含有的NH3分子數為2NA C.50mL 18mol/L濃硫酸與足量銅反應,被還原的硫酸的物質的量為0.9mol D.標準狀況下,11.2L SO3中含有氧原子1.5NA 組卷:4引用:1難度:0.5 -
8.中學化學中的氯水和氨水是非常重要的兩種“水”,下列說法正確的是( )
A.氯水的顏色呈淺黃綠色,說明Cl2與水不反應 B.氯水能使有色布條褪色,說明Cl2有漂白性 C.氨水是一元弱堿,其中只存在兩種分子NH3和NH3?H2O D.可用玻璃棒蘸取濃氨水靠近收集氯化氫的試管口檢驗氯化氫氣體 組卷:4引用:2難度:0.6 -
9.Mg-AgCl電池是一種能被海水激活的一次性貯備電池,電池反應方程式為2AgCl+Mg═Mg2++2Ag+2Cl-,有關該電池說法錯誤的是( )
A.鎂為電池負極 B.有24g鎂被氧化時,還原得到216g銀 C.正極反應為Ag++e-═Ag D.可用于海上應急照明 組卷:64引用:3難度:0.7 -
10.某種魚雷采用Al-Ag2O動力電池,該電池以溶解有氫氧化鉀的流動海水為電解液溶液,電池發生的總反應為:2Al+3Ag2O+2KOH═6Ag+2KAlO2+H2O,下列說法中正確的是( )
A.Ag2O為電池的負極 B.Al在該電池反應中被氧化 C.該電池將電能轉化為化學能 D.工作一段時間后溶液的pH增大 組卷:63引用:4難度:0.8 -
11.如圖所示為工業合成氨的流程圖。下列有關生產條件的調控作用分析正確的是( )

A.①中“凈化”可以防止催化劑中毒,③選擇高效催化劑可以使原料完全轉化成氨 B.②中“加壓”可以加快反應速率,因為在該壓強下催化劑的活性最大 C.③一般選擇控制反應溫度為700℃左右 D.④⑤有利于提高原料的利用率,能節約生產成本 組卷:26引用:1難度:0.7 -
12.下列關于SO2的說法不正確的是( )
A.  如圖裝置中血紅色褪去,可以驗證SO2的漂白性
如圖裝置中血紅色褪去,可以驗證SO2的漂白性B.工業制備硫酸后含SO2的尾氣大量排放至空氣中會形成酸雨 C.SO2與H2S氣體混合,產生淡黃色固體,體現了SO2的氧化性 D.SO2通入BaCl2溶液中無沉淀產生,通入BaCl2與NaOH的混合溶液中有BaSO3沉淀生成 組卷:138引用:4難度:0.5
三、填空題(共30分,除標注外,每空2分)
-
37.李克強總理在十二屆全國人大五次會議上作政府工作報告時強調:堅決打好藍天保衛戰。今年二氧化硫、氮氧化物排放量要分別下降3%,重點地區細顆粒物(PM2.5)濃度明顯下降。其中二氧化硫、氮氧化物等的排放與工業燃燒煤、石油等化石燃料有很大的關系,所以對廢氣進行脫硝、脫碳和脫硫處理可實現綠色環保、廢物利用。
Ⅰ.脫硝:催化劑存在下,H2還原NO2生成水蒸氣和另一種無毒氣體的化學方程式為。
Ⅱ.脫碳:一定條件下CO2會和H2反應合成CH3OH。方程式為:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)。現向2 L恒容密閉容器中加入2 mol CO2、6 mol H2,在恒溫下發生反應。10 s后反應達到平衡,此時容器內CH3OH的濃度為0.5 mol?L-1,請回答以下問題:
(1)前10 s內的平均反應速率v(H2O)=;平衡時CO2的轉化率為。
(2)下列敘述能說明原反應達到平衡狀態的是。
a.單位時間內消耗n mol CH3OH的同時生成n mol CO2
b.1 mol CO2生成的同時有3 mol H-H鍵斷裂
c.CO2和H2的濃度保持不變
d.容器內壓強保持不變
e.CO2和H2的物質的量之比保持不變
Ⅲ.脫硫:燃煤的煙氣脫硫技術是當前應用最廣、效率最高的脫硫技術。其更多的是利用堿溶液與煙道氣相遇,煙道氣中SO2溶解在水中,形成一種稀酸溶液,然后與Ca(OH)2濁液等發生中和反應。
(1)已知中和反應為常見的放熱反應,下列有關反應放熱、吸熱的說法正確的是。
a.可燃物燃燒一般都需要加熱,所以都是吸熱反應
b.化學鍵的斷裂要吸收能量
c.當反應物的總能量低于生成物的總能量時,據能量守恒定律可知反應會放熱
d.已知SO2(g)與O2(g)反應生成SO3(g)為放熱反應,則SO3(g)分解生成SO2(g)與O2(g)的反應為吸熱反應
(2)請寫出脫硫過程發生的主要化學方程式:。組卷:12引用:2難度:0.5 -
38.有關物質的轉化關系如圖所示(反應條件和部分產物未列出)。A是氣態氫化物,C和D的摩爾質量相差16g?mol-1,G是一種紫紅色金屬單質。

回答下面問題:
(1)若C是形成酸雨的主要大氣污染物之一,能使品紅溶液褪色,工業上常用于漂白紙漿、毛、絲等。
①寫出反應④的化學方程式。
②在A和C的反應中氧化產物和還原產物的質量之比為。
③已知反應②是可逆反應,寫出其逆反應的化學方程式。
(2)若0.5mol A中含有5NA個電子,D是一種紅棕色氣體。
①D的化學式是。
②寫出反應①的化學方程式。若反應中有1mol A被氧化,轉移電子為mol。組卷:3引用:1難度:0.6


