2022年山東省淄博市高考化學一模試卷
發布:2024/4/20 14:35:0
一、選擇題(本題包括10小題,每題只有一個選項符合題意;每題2分,共20分)
-
1.化學與科技和社會可持續發展密切相關。下列說法錯誤的是( )
A.我國科學家在國際上首次實現從CO2到淀粉的全合成,有助于實現“碳中和” B.“嫦娥五號”超聲電機運用的壓電陶瓷屬于新型無機非金屬材料 C.北京冬奧會中國運動服使用的聚氨酯纖維屬于天然有機高分子材料 D.中國科學院研發的“東方超環”(人造太陽)用到的氕、氘、氚互為同位素 組卷:40引用:2難度:0.7 -
2.為提純下列物質,除雜藥品和分離方法都正確的是( )
被提純的物質(雜質) 除雜藥品 分離方法 A 乙醇(乙酸) CaO 蒸餾 B KBr溶液(KI) 氯水、CCl4 萃取、分液 C 氯化鋁溶液(氯化鐵) 氨水 過濾 D CO2(SO2) 飽和Na2CO3溶液 洗氣 A.A B.B C.C D.D 組卷:91引用:2難度:0.5 -
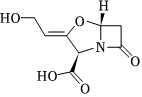 3.一種β-內酰胺酶抑制劑(結構簡式如圖)與抗生素聯用具有很好的殺菌效果。下列說法錯誤的是( )
3.一種β-內酰胺酶抑制劑(結構簡式如圖)與抗生素聯用具有很好的殺菌效果。下列說法錯誤的是( )A.其分子式為C8H9NO5 B.該分子存在順反異構現象 C.有4種含氧官能團 D.1mol該分子最多與3mol H2發生加成反應 組卷:47引用:4難度:0.6 -
4.短周期元素X、Y、Z、W、R的原子序數依次增大,Y與W同主族,Z與R同主族,它們形成的甲、乙兩種物質(如圖)是有機合成中常用的還原劑。下列說法正確的是( )
甲: ,乙
,乙
A.電負性:X>Z>R B.第一電離能:Y<Z<R C.元素Z和R最高價氧化物對應的水化物都具有兩性 D.單質Y和W在空氣中燃燒的產物所含化學鍵類型完全相同 組卷:41引用:3難度:0.5 -
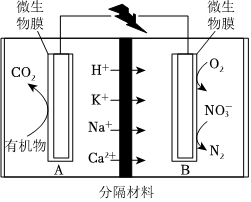 5.在微生物參與下,采用惰性電極處理污水中有機物的某微生物燃料電池原理如圖。下列說法錯誤的是( )
5.在微生物參與下,采用惰性電極處理污水中有機物的某微生物燃料電池原理如圖。下列說法錯誤的是( )A.有機物在微生物作用下被氧化并釋放質子 B.升高溫度可提高電池的能量轉化效率 C.B極發生的電極反應為:O2+4H++4e-═2H2O、2 +12H++10e-═N2↑+6H2ONO-3D.若該有機物為CH3OH,則反應1molCH3OH時轉移6mole- 組卷:39引用:2難度:0.6 -
6.研究CH3I與自由基Cl原子(用Cl*表示)的反應有助于保護臭氧層。已知:C*+CH3I反應有4條反應路徑(TS表示過渡態,IM表示中間物)如圖所示。下列說法錯誤的是( )
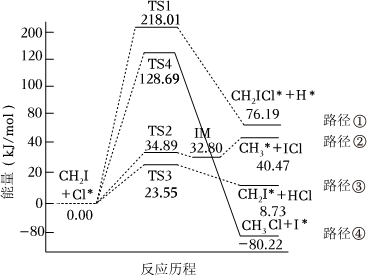
A.路徑①的ΔH>0 B.路徑②是基元反應 C.路徑③的速率最快 D.路徑④的逆反應的活化能最大 組卷:34引用:2難度:0.7
三.本題包括5小題,共60分。
-
19.某廢釩渣(主要成分為V2O3,含有少量Al2O3、CaO)為原料生產V2O5的工藝流程如圖:
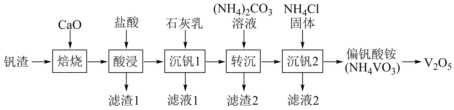
已知:釩酸(H3VO4)是強酸,NH4VO3難溶于水;+5價釩在溶液中的主要存在形式與溶液pH的關系如表。
(1)“酸浸”前需將塊狀固體粉碎,其目的是pH 4~6 6~8 8~10 10~12 主要離子 VO+2VO-3V2 O4-7VO3-4。
(2)已知Ca(VO3)2難溶于水,可溶于鹽酸。若“酸浸”時溶液的pH=4,則Ca(VO3)2溶于鹽酸的離子方程式為。
(3)Ksp(CaCO3)=m,Ksp[Ca3(VO4)2]=n;則反應Ca3(VO4)2(S)+3(aq)?2CO2-3(aq)+3CaCO3(s)的平衡常數為VO3-4(用含m、n的代數式表示)。
(4)“沉釩2”的沉釩率隨溫度的變化如圖所示,溫度高于80℃沉釩率下降的原因是。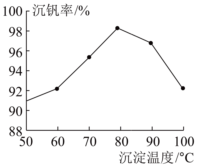
(5)NH4VO3灼燒脫氨可得V2O5在硫酸酸化條件下,V2O5可與草酸(H2C2O4)溶液反應得到含VO2+的溶液,反應的離子方程式為。
(6)測定產品中V2O5的純度:取ag產品用硫酸溶得(VO2)2SO4溶液,加入b1mLc1mol?L-1(NH4)2Fe(SO4)2溶液(+2H++Fe2+═VO2++Fe3++H2O),再用c2mol?L-1KMnO4溶液滴定過量的(NH4)2Fe(SO4)2至終點,消耗KMnO4溶液的體積為b2mL。已知VO+2被還原為Mn2+,假設雜質不參與反應。則產品中V2O5的質量分數是MnO-4(V2O5的摩爾質量為Mg?mol-1)。組卷:41引用:1難度:0.5 -
20.I.我國科學家利用CO2礦化反應釋放能量設計出CO2礦化電池。不僅減碳發電,還能獲得高附加值產品,其工作原理如圖1所示(Q是有機物;反應物和產物分別經過其它通道進入或排出電池容器)。
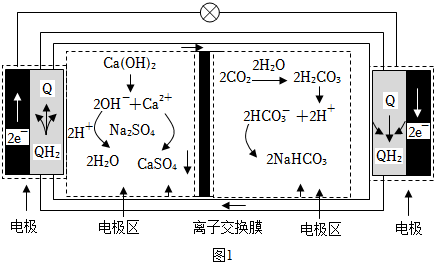
(1)通過離子交換膜的離子是,正極區的電極反應式為:Q+2CO2+2H2O+2Na+═2NaHCO3+QH2+2e-,在電極區溶液中可循環利用的物質是,則電池的總反應方程式為。
Ⅱ.以CO2為原料加氫合成二甲醚、甲醇有利于促進實現“碳中和”。在二氧化碳加氫制取二甲醚的合成塔中發生以下3個反應:
i.CO2(g)+3H2(g)?CH3OH(g)+H2O(g)ΔH=-49.01kJ?mol-1
ii.2CH3OH(g)?CH3OCH3(g)+H2O(g)ΔH=-24.52kJ?mol-1
iii.CO2(g)+H2(g)?CO(g)+H2O(g)ΔH=+41.17kJ?mol-1
(2)2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)的ΔH=kJ?mol-1
(3)在壓強3.0MPa、=4條件下,CO2的平衡轉化率和產物的選擇性與溫度的關系如圖2所示(選擇性是指生成某物質消耗的CO2占CO2消耗總量的百分比)。n(H2)n(CO2)
①當溫度超過290℃,CO2的平衡轉化率隨溫度升高而增大的原因是。除改變溫度外,能提高二甲醚選擇性的措施為(寫一種即可)。
②根據圖2中的數據計算300℃上述反應達到平衡時CH3OCH3的物質的量分數為(保留三位有效數字)。
(4)在=3時,反應CO2(g)+3H2(g)?CH3OH(g)+H2O(g)在不同條件下達到平衡,設體系中甲醇物質的量分數為x(CH3OH),在t=250℃下的xx(CH3OH)~P、在P=5×105Pa下的x(CH3OH)~t如圖3所示。當CO2的平衡轉化率為n(H2)n(CO2)時,反應條件可能為13。組卷:35引用:1難度:0.6


