2021-2022學年河北省滄州市任丘一中高二(上)段考化學試卷(一)
發(fā)布:2024/4/20 14:35:0
一、單項選擇題(共18個小題,每題僅有一個選項符合題意,每題2分,共36分)
-
1.2021年5月15日,我國火星探測器“天問一號”成功著陸火星。據(jù)介紹,該火星車除裝有光電轉換效率較高的4塊太陽電池板外,在其頂部還裝有一個像雙筒望遠鏡樣子的設備,叫作集熱窗,它可以直接吸收太陽能,然后利用一種叫作正十一烷的物質儲存能量。白天,火星溫度升高,這種物質吸熱融化,到了晚上溫度下降,這種物質在凝固的過程中釋放熱能。從上述資料中不能直接得出的結論是( )
A.“4塊太陽電池板”可將光能轉換成電能 B.“集熱窗”可將光能轉化成化學能儲存在化學物質中 C.物質的融化和凝固伴隨著能量的變化 D.“天問一號”的動力來源主要是太陽能和氫氧燃料電池 組卷:32引用:3難度:0.9 -
2.反應H2(g)+2ICl(g)═I2(g)+2HCl(g)ΔH=-218 kJ?mol-1分兩步進行,反應如下:
第一步 H2(g)+ICl(g)═HCl(g)+HI(g)ΔH=-83.2 kJ?mol-1慢反應
第二步HI(g)+ICl(g)═I2(g)+HCl(g)快反應
該反應的能量與反應歷程圖像正確的是( )A. 
B. 
C. 
D.  組卷:106引用:6難度:0.5
組卷:106引用:6難度:0.5 -
3.下列關于熱能的說法正確的是( )
A.已知2H2(g)+O2(g)═2H2O(g)ΔH=-571.6 kJ/mol,則氫氣的燃燒熱為-285.8 kJ/mol B.已知2C(s)+2O2(g)═2CO2(g) ΔH1;2C(s)+O2(g)═2CO(g) ΔH2,則ΔH1>ΔH2 C.鹽酸和NaOH溶液反應的中和熱ΔH=-57.3kJ/mol,則NaOH溶液和醋酸溶液反應的中和熱ΔH<-57.3kJ/mol D.同溫同壓下,H2(g)+Cl2(g)═2HCl(g)在光照和點燃條件下的ΔH相同 組卷:18引用:1難度:0.6 -
4.下列說法正確的是( )
A.對于2A(s)+B(g)?2C(g)的反應,加入A,反應速率加快 B.2NO2?N2O4(正反應放熱),升高溫度,v(正)增大,v(逆)減小 C.100mL 2mol/L稀鹽酸與足量的鋅反應時,加入少量硫酸銅固體,生成氫氣的速率加快 D.一定溫度下,反應N2(g)+3H2(g)?2NH3(g)在密閉容器中進行,恒壓,充入He反應速率不變 組卷:114引用:6難度:0.4 -
5.下列有關化學反應速率的說法正確的是( )
A.凡是能量達到活化能的分子發(fā)生的碰撞均為有效碰撞 B.增大反應物濃度能加快正反應的反應速率,降低逆反應的反應速率 C.溫度升高使化學反應速率加快的主要原因是增加了反應物分子之間的碰撞次數(shù) D.決定化學反應速率的根本因素是參加反應的各物質的性質 組卷:25引用:7難度:0.9 -
6.二氧化鈦在一定波長光的照射下,可有效降解甲醛、苯等有機物,效果持久,且自身對人體無害。某課題組研究了溶液的酸堿性對TiO2光催化染料R降解反應的影響,結果如圖所示。下列判斷正確的是( )

A.在0~20min之間,pH=7時R的降解速率為0.07mol?L-1?min-1 B.R的起始濃度不同,無法判斷溶液的酸堿性對R降解速率的影響 C.在0~50min之間,R的降解百分率:pH=2大于pH=7 D.二氧化鈦對pH=2的R溶液催化效率好 組卷:61引用:4難度:0.7 -
7.我國科學家實現(xiàn)了在銅催化條件下將DMF[(CH3)2NCHO]轉化為三甲胺[N(CH3)3]。計算機模擬單個DMF分子在銅催化劑表面的反應歷程如圖所示,下列說法正確的是( )

A.由圖可以判斷DMF轉化為三甲胺的反應屬于吸熱反應 B.N(CH3)3+OH*+H*═N(CH3)3(g)+H2O(g)是該反應歷程的決速步 C.使用銅作催化劑可以降低反應的活化能,從而改變反應的焓變 D.該歷程中最大能壘(活化能)E正=2.16eV 組卷:64引用:3難度:0.5 -
8.下列說法不正確的是( )
A.ΔH<0、ΔS>0的反應在任何溫度下都能自發(fā)進行 B.NH4HCO3(s)=NH3(g)+H2O(g)+CO2(g) ΔH=+185.57 kJ?mol-1能自發(fā)進行,原因是體系有自發(fā)地向混亂度增加的方向轉變的傾向 C.因為焓變和熵變都與反應的自發(fā)性有關,因此焓變或熵變均可以單獨作為反應自發(fā)性的判據(jù) D.對于同一物質來講,熵值的大小與其狀態(tài)有關,固態(tài)物質的熵值通常最小 組卷:37引用:4難度:0.7
三、解答題(共3小題,滿分48分)
-
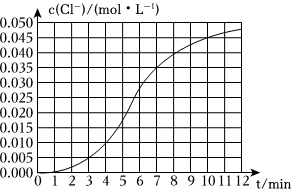 24.某化學小組欲測定KClO3溶液與NaHSO4溶液反應的化學反應速率,所用試劑為10mL 0.1mol?L-1KClO3溶液和10mL 0.3mol?L-1 NaHSO4溶液,所得實驗數(shù)據(jù)如圖所示。
24.某化學小組欲測定KClO3溶液與NaHSO4溶液反應的化學反應速率,所用試劑為10mL 0.1mol?L-1KClO3溶液和10mL 0.3mol?L-1 NaHSO4溶液,所得實驗數(shù)據(jù)如圖所示。
已知:+3ClO-3═Cl-+3HSO-3+3H+。SO2-4
(1)該反應在0~4min的化學反應速率v(Cl-)=mol?L-1?min-1。
(2)某同學仔細分析實驗數(shù)據(jù)后發(fā)現(xiàn),在反應過程中該反應的化學反應速率先增大后減小。
i.小組同學針對這一現(xiàn)象,通過測定c(Cl-)隨時間變化的情況,進一步探究影響因素,具體情況見表。
①補全方案1中的實驗操作:方案 假設 具體實驗操作
1該反應放熱,使溶液溫度升高,化學反應速率加快 向燒杯中依次加入10mL 0.1mol/LKClO3溶液和10mL 0.3 mol/LNaHSO3溶液, 。2 取10 mL0.1mol/LKClO3溶液于燒杯中,向其中加入少量氯化鈉固體,再加入10mL0.3 mol/LNaHSO3溶液。 3 溶液酸性增強,加快了化學反應速率 分別向標號①②的兩只燒杯中加入10mL 0.1mol?L-1KClO3溶液,向
燒杯①:加入1mL水,向燒杯②加入1mL 0.2mol?L-1鹽酸;然后分別向這兩只燒杯中加入10 mL 0.3 mol?L-1NaHSO3溶液。。
②方案2中的假設為。
③除方案1、2、3中的假設外,還可以提出的假設是。
④在已知方案1的假設不成立的情況下,某同學從控制變量的角度思考,認為方案3中實驗操作設計不嚴謹,請進行改進:。
ii.反應后期,化學反應速率降低的原因是。組卷:29引用:7難度:0.6 -
25.甲醇既是重要的化工原料,又可作為燃料,還可以作為燃料電池的原料。利用合成氣(主要成分為CO、CO2和H2)在催化劑的作用下合成甲醇,發(fā)生的主要反應如下:CO(g)+2H2(g)?CH3OH(g) ΔH (已知:CO的結構與N2相似)回答下列問題:
(1)已知反應中相關的化學鍵鍵能數(shù)據(jù)如下:
由此計算ΔH=化學鍵 H—H C—O C≡O H—O C—H E/(kJ/mol) 436 343 1076 465 413 kJ?mol-1
(2)工業(yè)上制二甲醚是在一定溫度(230~280℃)、壓強(2.0~10.0MPa)和催化劑作用下進行的,反應器中發(fā)生了下列反應:
CO(g)+2H2(g)?CH3OH(g)ΔH1=-90.7kJ?mol-1①
2CH3OH(g)?CH3OCH3(g)+H2O(g)ΔH2=-23.5kJ?mol-1②
CO(g)+H2O(g)?CO2(g)+H2(g)ΔH3=-41.2kJ?mol-1③
反應器中的總反應可表示為3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g),計算該反應的ΔH=。
(3 ) 催化硝化法和電化學降解法可用于治理水中硝酸鹽的污染.
①催化硝化法中,用H2將還原為N2,一段時間后,溶液的堿性明顯增強.則該反應離子方程式為NO-3.
②電化學降解的原理如圖所示,電源正極為NO-3(填“A”或“B”),若總反應4+4H+═5O2+2N2+2H2O,則陰極反應式為NO-3。
③能否把質子交換膜改為陰離子交換膜。(填“能”或“不能”)組卷:42引用:3難度:0.5


