2022-2023學年江蘇省北大附中宿遷實驗學校高二(上)開學化學試卷
發布:2024/9/4 1:0:8
一、單選題(本大題共20小題,共60.0分)
-
1.下列圖示變化為吸熱反應的是( )
A. 
B. 
C. 
D.  組卷:28引用:3難度:0.6
組卷:28引用:3難度:0.6 -
2.某同學設計如圖所示實驗,探究反應中的能量變化。下列判斷正確的是( )

A.由實驗可知,(a)、(b)、(c)所涉及的反應都是放熱反應 B.將實驗(a)中的鋁片更換為等質量的鋁粉后釋放出的熱量有所增加 C.實驗(c)中將環形玻璃攪拌棒改為鐵質攪拌棒對實驗結果沒有影響 D.若用NaOH固體測定中和反應的反應熱,則測定的反應熱△H的絕對值偏高 組卷:24引用:6難度:0.6 -
3.標準狀態下,氣態分子斷開1mol化學鍵的焓變稱為鍵焓。已知H-H、H-O和O=O鍵的鍵焓ΔH分別為436kJ?mol-1、463kJ?mol-1和495kJ?mol-1。下列熱化學力程式正確的是( )
A.2H2(g)+O2(g)═2H2O(g)ΔH=-485kJ?mol-1 B.2H2(g)+O2(g)═2H2O(g)ΔH=+485kJ?mol-1 C.H2O(g)═H2(g)+ O2(g)ΔH=+485kJ×mol-112D.H2O(g)═H2+ O2(g)ΔH=-485kJ×mol-112組卷:9引用:2難度:0.5 -
4.聯氨(N2H4)常溫下為無色液體,可用作火箭燃料。下列說法不正確的是( )
①2O2(g)+N2(g)═N2O4(l)△H1
②N2(g)+2H2(g)═N2H4(l)△H2
③O2(g)+2H2(g)═2H2O(g)△H3
④2N2H4(l)+N2O4(l)═3N2(g)+4H2O(g)△H4=-1048.9kJ?mol-1A.△H4=2△H3-2△H2-△H1 B.O2(g)+2H2(g)═2H2O(l)△H5,△H5>△H3 C.1mol O2(g)和2mol H2(g)具有的總能量高于2mol H2O(g) D.聯氨和N2O4作火箭推進劑的原因之一是反應放出大量的熱且產物無污染 組卷:196引用:4難度:0.5 -
5.由U形管、質量為mg的鐵棒、質量為mg的碳棒和1L0.2mol?L-1CuCl2溶液組成的裝置如圖所示,下列說法正確的是( )

A.閉合K,電子通過電解質溶液移到碳棒上 B.閉合K,鐵棒上有紫紅色固體析出 C.閉合K,鐵棒表面發生的電極反應為Cu2++2e-═Cu D.閉合K,當電路中有0.3NA個電子通過時,理論上碳棒與鐵棒的質量差為18g 組卷:44引用:3難度:0.7 -
6.原電池構成是有條件的,關于如圖所示裝置的敘述,錯誤的是( )
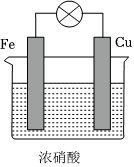
A.Cu是負極,其質量逐漸減小 B.H+向鐵電極移動 C.Cu片上有紅棕色氣體產生 D.Fe電極上發生還原反應 組卷:29引用:3難度:0.7 -
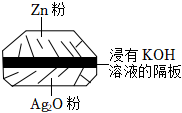 7.新冠肺炎最明顯的癥狀就是出現發熱,體溫槍能快速檢測人體體溫。該體溫槍所用的電池為一種銀鋅電池(如圖所示),該電池的總反應式為:Zn+Ag2O+H2O═Zn(OH)2+2Ag。下列關于該電池的說法正確的是( )
7.新冠肺炎最明顯的癥狀就是出現發熱,體溫槍能快速檢測人體體溫。該體溫槍所用的電池為一種銀鋅電池(如圖所示),該電池的總反應式為:Zn+Ag2O+H2O═Zn(OH)2+2Ag。下列關于該電池的說法正確的是( )A.Ag2O電極作正極,發生氧化反應 B.該電池放電時溶液中的K+向Zn電極移動 C.電池工作時,電流從Ag2O電極經過隔板流向Zn電極 D.該電池的負極反應為:Zn-2e-+2OH-═Zn(OH)2 組卷:58引用:7難度:0.7 -
 8.一種應用比較廣泛的甲醇燃料電池,電解液是酸性溶液,其工作原理如圖所示,下列說法正確的是( )
8.一種應用比較廣泛的甲醇燃料電池,電解液是酸性溶液,其工作原理如圖所示,下列說法正確的是( )A.M極為負極,發生還原反應 B.N極電極反應為O2+4H+-4e-=2H2O C.甲池溶液pH增大,乙池溶液pH減小 D.若有1molCO2生成,則有6molH+從甲池通過交換膜進入乙池 組卷:107引用:3難度:0.5
二、填空題(本大題共3小題,共34.0分)
-
23.Ⅰ.一定溫度下,在2L的密閉容器中,X、Y、Z三種氣體的量隨時間變化的曲線如圖:
(1)從反應開始到10s時,用Z表示的反應速率為,X的物質的量濃度減少了,Y的轉化率為。
(2)該反應的化學方程式為。
Ⅱ.KI溶液在酸性條件下能與氧氣反應。現有以下實驗記錄:回答下列問題:
(3)該反應的離子方程式為實驗編號 ① ② ③ ④ ⑤ 溫度/℃ 30 40 50 60 70 顯色時間/s 160 80 40 20 10 。
(4)實驗試劑除了1mol?L-1KI溶液、0.1mol?L-1H2SO4溶液外,還需要的試劑是;
(5)上述實驗操作中除了需要(3)的條件外,還必須控制不變的是(填字母)。
A.溫度
B.試劑的濃度
C.試劑的用量(體積)
D.試劑添加的順序組卷:6引用:3難度:0.6
三、計算題(本大題共1小題,共6.0分)
-
24.已知反應:2SO2+O2
2SO3,4molSO2和2molO2在2L的密閉容器中反應2min后,SO2的物質的量濃度為1.5mol/L,求SO2、O2、SO3的反應速率催化劑△、、。組卷:58引用:2難度:0.7


