2022-2023學年河南省洛陽市六校高二(上)第一次月考化學試卷
發布:2024/4/20 14:35:0
一、單項選擇題(共14個小題,每小題3分,共42分。每題有且僅有一個正確選項)。
-
1.下列物質的水溶液,因溶質發生水解顯堿性的是( )
A.Na2O B.CH3COONa C.NH4Cl D.KOH 組卷:25引用:2難度:0.6 -
2.下列溶液一定顯中性的是( )
A.溶液中c(OH-)=c(H+) B.滴加石蕊試液后呈紫色的溶液 C.溶液中c(H+)=10-7mol?L-1 D.pH=7的溶液 組卷:43引用:2難度:0.7 -
3.將下列固體物質溶于水,再將其溶液加熱,蒸發結晶再灼燒,得到化學組成與原固體物質相同的是( )
①膽礬
②氯化鐵
③硫酸鋁
④氯化銅A.②③ B.①④ C.③ D.① 組卷:52引用:3難度:0.6 -
4.下列方程式正確的是( )
A.CH3COONa的電離:CH3COONa?CH3COO-+Na+ B.HCO3-的水解:HCO3-+H2O?H3O++CO32- C.向硫酸鋁溶液中滴加碳酸鈉溶液:2Al3++3CO32-═Al2(CO3)3↓ D.FeCl3的電離:FeCl3═Fe3++3Cl- 組卷:4引用:2難度:0.6 -
5.下列說法正確的是( )
A.向10ml氨水中逐滴加入蒸餾水的過程中,NH3?H2O的電離程度增大 B.將NaOH溶液和鹽酸溶液中的溶質濃度各稀釋到原濃度的一半,兩者的c(OH-)均減少為原來的一半 C.物質的量濃度相同的亞硫酸鈉溶液和亞硫酸溶液中SO32-的濃度相等 D.用標準高錳酸鉀溶液滴定草酸溶液時,需要使用的儀器有酸式滴定管、堿式滴定管、錐形瓶 組卷:26引用:2難度:0.6 -
6.根據下列反應原理設計的應用,不正確的是( )
A.CO32-+H2O?HCO3-+OH-用熱的純堿溶液清洗油污效果更佳 B.Al3++3H2O?Al(OH)3(膠體)+3H+明礬凈水 C.Cl2+H2O?HCl+HClO新制氯水中加入碳酸鹽,提高次氯酸濃度 D.Fe3++3H2O?Fe(OH)3+3H+配制Fe2(SO4)3溶液時,加入一定量Fe粉 組卷:37引用:2難度:0.6
二、填空題(共4個小題,共58分)。
-
17.按要求回答下列問題:
(1)設AG=lg,常溫下,pH=12的Ba(OH)2與0.01mol/LNaHSO4等體積混合,則溶液中的AG=c(H+)c(OH-)。
(2)已知25℃時,Na2CO3的Kh1=2×10-4mol?L-1,則當Na2CO3溶液中c():c(HCO-3)=2:1時,求溶液的pH=CO2-3。
(3)常溫下,pH=2的某酸(HxA)溶液與pH=12的某堿[B(OH)y]溶液等體積混合,充分反應后溶液的pH為10,若該鹽中只存在一種能水解的離子,則水解的離子方程式為,混合溶液中水電離出的c(H+)=。
(4)某溫度下,測得0.01mol/LNaOH溶液的pH=11,則將此溫度下pH=12的NaOH溶液VxL與pH=2的H2SO4溶液VyL混合,所得溶液pH=10,則Vx:Vy=。
(5)室溫時,CH3COOH的Ka=1.8×10-5,將amol/L醋酸與bmol/LBa(OH)2溶液以2:1體積比混合(忽略溶液體積變化),若混合溶液中2c(Ba2+)=c(CH3COO-),則溶液呈性,混合后溶液中CH3COOH的濃度為mol/L。(用含相關字母的最簡代數式表示)
(6)常溫下,用300mL濃度為1mol/L的Na2SO3溶液吸收SO2的過程中,溶液pH隨吸收SO2物質的量的變化曲線如圖所示: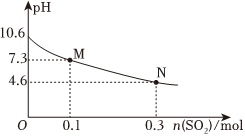
常溫下,H2SO3的二級電離平衡常數Ka2約為。組卷:47引用:3難度:0.7 -
18.我國規定:室內甲醛含量不得超過0.08mg?m-3。某研究性學習小組欲利用酸性KMnO4溶液測定空氣中甲醛的含量(假設空氣中無其他還原性氣體)。
【測定原理】4+5HCHO+12H+═4Mn2++5CO2↑+11H2OMnO-4
【測定裝置】部分裝置如圖1所示
(1)【測定步驟】
①檢查裝置的氣密性(氣密性良好);
②用量取25.00mL2×10-4mol/LKMnO4溶液于洗氣瓶中,并滴入幾滴H2SO4酸化,插入KMnO4溶液的管子下端為具有多孔的球泡(圖2),其優點為;
③將1.00×10-3mol/L草酸標準溶液置于酸式滴定管中備用;
④(填針對活塞a、b的具體操作),用注射器抽取100mL新裝修的房屋室內空氣。(填針對活塞a、b的具體操作),再推動注射器,將氣體全部推入酸性高錳酸鉀溶液中,使其充分反應。
⑤再重復④操作4次;
⑥將洗氣瓶中溶液(包括洗滌液)轉移到中,再用標準草酸溶液進行滴定。有關滴定管的正確操作順序為:DG。
A.蒸餾水洗滌
B.裝入滴定液至零刻度以上
C.調整滴定液液面至零刻度或零刻度以下
D.檢漏
E.排除氣泡
F.用滴定液潤洗2至3次
G.記錄起始讀數
實驗過程中判斷滴定終點的現象為,記錄滴定所消耗的草酸溶液的體積;
⑦再重復實驗2次,實驗所消耗草酸溶液的體積平均值為12.38mL。
(2)【交流討論】
①計算該居室內空氣中甲醛的濃度mg?m-3,該居室的甲醛(填是或否)超標。
②某同學用該方法測量空氣中甲醛的含量時,所測得的數值比實際含量低,請你對其可能的原因(假設溶液配制、稱量或量取及滴定實驗均無錯誤)提出合理假設:。組卷:6引用:2難度:0.5


