2021-2022學年廣東省茂名五中高二(上)期中化學試卷
發布:2024/9/20 3:0:8
一、選擇題:本題共16小題,共44分。第1~10小題,每小題2分;第11~16小題,每小題2分。在每小題給出的四個選項中,只有一項是符合題目要求的。
-
1.N2和H2在催化劑表面合成氨的微觀歷程及能量變化的示意圖如下,用
 、
、 、
、 分別表示N2、H2、NH3,已知:N2(g)+3H2(g)?2NH3(g),該反應屬于放熱反應。下列說法正確的是( )
分別表示N2、H2、NH3,已知:N2(g)+3H2(g)?2NH3(g),該反應屬于放熱反應。下列說法正確的是( )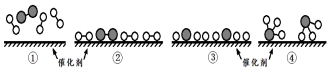
A.催化劑僅起到吸附N2和H2的作用,對化學反應速率沒有影響 B.②→③過程,是放熱過程 C.③→④過程,N原子和H原子形成了含有非極性鍵的NH3 D.合成氨反應中,反應物斷鍵吸收能量小于生成物形成新鍵釋放的能量 組卷:8引用:2難度:0.5 -
2.下列熱化學方程式書寫正確的是( )
A.2SO2+O2 2SO3△H=-196.6 kJ?mol-1催化劑加熱B.H2(g)+ O2(g)═H2O(l)△H=-285.8 kJ?mol-112C.2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ D.C(s)+O2(g)═CO2(g)△H=+393.5 kJ?mol-1 組卷:124引用:7難度:0.8 -
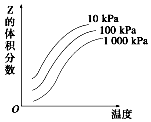 3.如圖是溫度和壓強對X+Y?2Z反應影響的示意圖。圖中橫坐標表示溫度,縱坐標表示平衡混合氣體中Z的體積分數。下列敘述正確的是( )
3.如圖是溫度和壓強對X+Y?2Z反應影響的示意圖。圖中橫坐標表示溫度,縱坐標表示平衡混合氣體中Z的體積分數。下列敘述正確的是( )A.上述可逆反應的正反應為放熱反應 B.X、Y、Z均為氣態 C.X和Y中最多只有一種為氣態,Z為氣態 D.上述反應的逆反應的△H>0 組卷:274引用:8難度:0.7 -
4.用水稀釋0.1mol?L-1的NH3?H2O溶液,其中隨水的量增加而增大的是( )
①c(OH-)
②n(OH-)
③c(OH-)c(NH3?H2O)
④c(NH3?H2O)c(H+)
⑤c(NH4+)A.①② B.②③ C.④⑤ D.③⑤ 組卷:14引用:3難度:0.6 -
5.德國哈伯發明以低成本制造大量氨的方法,流程圖中為提高原料轉化率而采取措施是( )
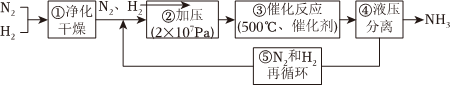
A.①②③ B.②④⑤ C.①③⑤ D.②③④ 組卷:208引用:13難度:0.7 -
6.下列按強電解質、弱電解質、酸性氧化物、堿性氧化物的組合,正確的是( )
選項 強電解質 弱電解質 酸性氧化物 堿性氧化物 A Ca(OH)2 酒精 N2O5 Na2O B CaSO4 H2CO3 SO2 CaO C NaHCO3 氨水 Mn2O7 Al2O3 D HCl HF CO Na2O2 A.A B.B C.C D.D 組卷:255引用:4難度:0.6
二、非選擇題:(共56分)。
-
19.重鉻酸鈉晶體(Na2Cr2O7?H2O)為橙紅色,是一種重要的無機鹽產品。可以由鉻鐵礦[主要含Fe(CrO2)2,還含少量MgO、Al2O3、SiO2等]制備,主要工藝流程如圖:
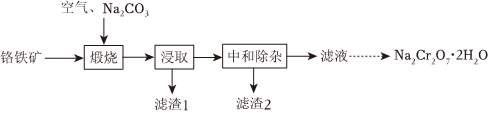
已知:①Cr(VI)在水溶液中常以H2CrO4、、HCrO-4、Cr2CrO2-4等形態存在;本實驗條件下,當pH約為3.5時O2-7轉化為Cr2CrO2-4。O2-7
②酸性條件下,Cr(VI)具有較強的氧化性,易被還原成Cr(III)。
請回答下列問題:
(1)“煅燒”時,Fe(CrO2)2轉化為Na2CrO4和Fe2O3,寫出鉻鐵礦發生的主要反應的化學方程式。
(2)“中和除雜”時,先用水將浸取液稀釋,并加熱至接近沸騰,然后調節溶液pH約為7。
①加熱至接近沸騰的目的為。
②若持續加熱較長時間,可以通過生成Na2O?Al2O3?2SiO2?2H2O而將硅除去,寫出相應的離子方程式。
(3)室溫下,“中和除雜”后所得的濾液中存在下列平衡;
H2CrO4?H++K1=4.1HCrO-4?H++HCrO-4K2=3.0×10-7CrO2-4
2?Cr2HCrO2-4+H2O K3=45O2-7
①室溫下,反應2+2H+?Cr2CrO2-4+H2O的平衡常數K=O2-7;酸化時,通常用硫酸而不用鹽酸,原因是CrO2-4。
②如圖為Na2SO4和Na2Cr2O7的溶解度隨溫度變化關系曲線。由“中和除雜”后所得的濾液制備重鉻酸鈉晶體的實驗方案為。(必須使用的試劑有:硫酸、蒸餾水)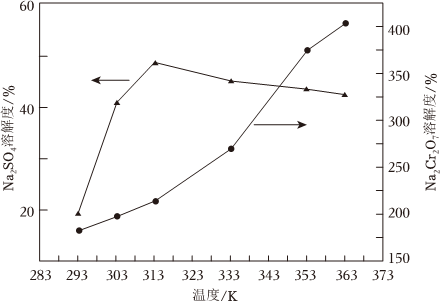 組卷:38引用:3難度:0.5
組卷:38引用:3難度:0.5 -
20.(1)分別與足量的鋅粉發生反應,下列關于氫氣體積(V)隨時間(t)變化的示意圖正確的是
(填字母)。(①表示鹽酸,②表示醋酸)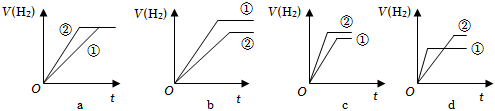
(2)常溫下,濃度均為0.1mol?L-1的下列五種鈉鹽溶液的pH如下表;
上述鹽溶液中的陰離子,結合H+能力最強的溶質 CH3COONa NaHCO3 Na2CO3 NaClO NaCN pH 8.8 9.7 11.6 10.3 11.1 ,根據表中數據,濃度均為0.01mol?L-1的下列四種酸的溶液分別稀釋100倍,pH變化最大的是(填編號)。
A.HCN
B.HClO
C.CH3COOH
D.H2CO3
(3)常溫下,有下列2種溶液:鹽酸、醋酸。
①向等體積、等濃度的鹽酸和醋酸溶液中加入大小相同的鎂條,開始時反應速率分別為v1、v2,其大小關系為。
②等體積、等pH的的鹽酸和醋酸溶液分別與足量的等濃度的NaOH溶液反應,消耗NaOH溶液的體積分別為a、b,其大小關系為。
(4)25℃時,兩種酸的電離平衡常數如下表。
①在相同條件下,試比較H2CO3、Ka1 Ka2 H2SO3 1.3×10-2 6.3×10-8 H2CO3 4.2×10-7 5.6×10-11 和HCO-3的酸性從強到弱順序為HSO-3。
②向Na2CO3溶液中加入足量NaHSO3溶液,反應的離子方程式為。組卷:8引用:2難度:0.6


