2022-2023學(xué)年重慶市七校(江津中學(xué)、大足中學(xué)、長(zhǎng)壽中學(xué)、銅梁中學(xué)、合川中學(xué)、綦江中學(xué)、實(shí)驗(yàn)中學(xué))高二(上)期末化學(xué)試卷
發(fā)布:2024/4/20 14:35:0
一、選擇題:本題共14小題,每小題3分,共42分。在每小題給出的四個(gè)選項(xiàng)中,只有一項(xiàng)是符合題目要求的。
-
1.2018年10月24日港珠澳大橋正式通車(chē)。深埋在海水中的鋼管樁易發(fā)生腐蝕,但中科院金屬所技術(shù)能保障大橋120年耐久性。下列保護(hù)鋼管樁的措施不合理的是( )
A.鋼管樁附著銅以增強(qiáng)抗腐蝕性 B.在鋼筋表面附上新一代高性能環(huán)氧涂層 C.使用抗腐蝕性強(qiáng)的合金鋼 D.將鋼管樁連通電源負(fù)極 組卷:65引用:5難度:0.8 -
2.某化學(xué)研究性學(xué)習(xí)小組在學(xué)習(xí)了《化學(xué)反應(yīng)原理》后作出了如下的歸納總結(jié),其中不正確的是( )
A.夏天,打開(kāi)啤酒瓶時(shí)會(huì)在瓶口逸出氣體,可以用勒夏特列原理解釋 B.使用催化劑既不會(huì)改變反應(yīng)的限度也不會(huì)改變反應(yīng)的焓變 C.強(qiáng)電解質(zhì)溶液的導(dǎo)電能力比弱電解質(zhì)溶液的導(dǎo)電能力都強(qiáng) D.實(shí)驗(yàn)室盛放Na2CO3、Na2SiO3等堿性溶液的試劑瓶應(yīng)用橡膠塞,而不能用玻璃塞 組卷:22引用:2難度:0.5 -
3.常溫下,將0.2mol?L-1HCl溶液與0.2mol?L-1Ba(OH)2溶液等體積混合,該混合溶液的pH等于( )(混合后體積變化忽略不計(jì))
A.1 B.7 C.13 D.14 組卷:26引用:1難度:0.6 -
4.下列化學(xué)用語(yǔ)對(duì)事實(shí)的表述正確的是( )
A.NaHCO3溶液的水解方程式: +H2O?H3O++HCO-3CO2-3B.用銅作陽(yáng)極電解稀硫酸:Cu+2H+ Cu2++H2↑電解C.向AgCl懸濁液中滴入KI溶液:Ag+(aq)+I-(aq)?AgI(s) D.明礬[KAl(SO4)2?12H2O]常作凈水劑:Al3++3H2O=Al(OH)3(膠體)+3H+ 組卷:12引用:2難度:0.8 -
5.某溫度下,將一定量碳酸氫銨固體置于容積不變密閉容器中,發(fā)生反應(yīng):NH4HCO3(s)?NH3(g)+H2O(g)+CO2(g) ΔH=akJ?mol-1(a>0)。下列有關(guān)說(shuō)法不正確的是( )
A.該反應(yīng)在高溫條件下能自發(fā)進(jìn)行 B.若容器內(nèi)混合氣體的密度不變,則說(shuō)明反應(yīng)達(dá)到平衡狀態(tài) C.若升高體系溫度,則正、逆反應(yīng)速率均增大 D.反應(yīng)達(dá)到平衡后,保持容器體積和溫度不變,再往容器中充入一定量He,則平衡逆向移動(dòng) 組卷:28引用:3難度:0.5 -
6.下列敘述正確的是( )
A.向氨水中加入醋酸使溶液呈酸性,則c( )>c(CH3COO-)NH+4B.向NH4Cl溶液中加入少量Al2(SO4)3固體,則 的水解程度增大NH+4C.向pH相同,體積相等的鹽酸和醋酸溶液中,分別加入等濃度的NaOH溶液,則消耗NaOH溶液的體積前者小于后者 D.向0.2mol?L-1磷酸中加水稀釋至原體積的兩倍,則c(H+)>0.1mol?L-1 組卷:41引用:2難度:0.7
二、填空題:本題共4小題,共58分。
-
 17.將CO2轉(zhuǎn)化為CO、CH3OH等燃料,可以有效的緩解能源危機(jī),同時(shí)可以減少溫室氣體,實(shí)現(xiàn)“雙碳目標(biāo)”。
17.將CO2轉(zhuǎn)化為CO、CH3OH等燃料,可以有效的緩解能源危機(jī),同時(shí)可以減少溫室氣體,實(shí)現(xiàn)“雙碳目標(biāo)”。
(1)t℃時(shí),H2還原CO2的熱化學(xué)方程式如下:
Ⅰ:CO2(g)+H2(g)?CO(g)+H2O(g)ΔH1=+41kJ?mol-1
Ⅱ:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)ΔH2=-49.5kJ?mol-1
已知反應(yīng)Ⅰ、Ⅱ的平衡常數(shù)分別為K1、K2。由蓋斯定律可知,CO(g)與2molH2(g)反應(yīng)生成CH3OH(g)的熱化學(xué)方程式為,K=(用K1、K2表示)。
(2)若反應(yīng)Ⅰ的正反應(yīng)活化能表示為EkJ?mol-1,則E41(填“>”“<”或“=”)。
(3)t℃,向10L密閉容器中充入1molCO2和2.5molH2,發(fā)生反應(yīng)Ⅰ,5min達(dá)到平衡時(shí),測(cè)得CO的物質(zhì)的量為0.5mol。
①平衡時(shí)CO的體積分?jǐn)?shù)=。
②下列措施既能加快反應(yīng)速率又能提高CO2的平衡轉(zhuǎn)化率的是。
A.升高反應(yīng)溫度
B.增大H2的濃度
C.分離出CO
D.縮小容器容積
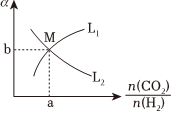
③t℃,向10L密閉容器中充入2molCO2和一定量的H2,發(fā)生反應(yīng)Ⅰ,兩種氣體的平衡轉(zhuǎn)化率(a),與起始反應(yīng)物的物質(zhì)的量之比的關(guān)系如圖所示:n(CO2)n(H2)
能表示CO2平衡轉(zhuǎn)化率曲線的是(填L1或L2),M點(diǎn)的縱坐標(biāo):b=。
④在t℃,壓強(qiáng)為P時(shí),Kp=。(用平衡分壓代替平衡濃度計(jì)算,分壓=總壓×物質(zhì)的量分?jǐn)?shù))組卷:21引用:2難度:0.5 -
18.我國(guó)重晶石(含BaSO490%以上)資源豐富,其中貴州省重晶石儲(chǔ)量占全國(guó)總儲(chǔ)量的三分之一。某工廠以重晶石為原料,生產(chǎn)“電子陶瓷工業(yè)支柱”—鈦酸鋇(BaTiO3)的工藝流程如圖:

查閱資料可知:
①常溫下:Ksp(BaSO4)=1.0×10-10,Ksp(BaCO3)=2.5×10-9。
②TiCl4在常溫下是無(wú)色液體,遇水容易發(fā)生水解:TiCl4+2H2O=TiO2+4HCl。
③草酸氧鈦鋇的化學(xué)式為BaTiO(C2O4)2?4H2O。
請(qǐng)回答下列問(wèn)題:
(1)BaTiO(C2O4)2?4H2O中Ti元素的化合價(jià)為。
(2)工業(yè)上用飽和Na2CO3溶液處理重晶石(假設(shè)雜質(zhì)不與Na2CO3溶液作用),待達(dá)到平衡后,移走上層清液,重復(fù)多次操作,將BaSO4轉(zhuǎn)化為易溶于酸的BaCO3,該反應(yīng)的平衡常數(shù)K=(填寫(xiě)計(jì)算結(jié)果)。當(dāng)Na2CO3溶液的濃度大于mol?L-1時(shí)就能實(shí)現(xiàn)BaSO4轉(zhuǎn)化為BaCO3。(不考慮的水解)CO2-3
(3)配制TiCl4溶液時(shí)通常將TiCl4固體溶于濃鹽酸再加水稀釋?zhuān)淠康氖?。
(4)寫(xiě)出混合液加入TiCl4和H2C2O4溶液反應(yīng)的化學(xué)方程式。。
(5)檢驗(yàn)草酸氧鈦鋇晶體是否洗凈的方法。
(6)煅燒草酸氧鈦鋇晶體得到BaTiO3的同時(shí),高溫下生成的氣體產(chǎn)物有CO、和(填化學(xué)式)。組卷:11引用:2難度:0.6


