2015-2016學(xué)年海南省樂東思源高級中學(xué)高一(上)單元測試卷《水溶液中的離子平衡》
發(fā)布:2024/4/20 14:35:0
一、選擇題(共17小題,每小題3分,共54分,每小題只有一個選項符合題意)
-
1.由硫酸鉀、硫酸鋁和硫酸組成的混合溶液,pH=1,c(Al3+)=0.4mol?L-1,c(SO42-)=0.8mol?L-1,則c(K+)=( )
A.0.15 mol?L-1 B.0.2 mol?L-1 C.0.3 mol?L-1 D.0.4 mol?L-1 組卷:210引用:29難度:0.7 -
2.對H2O的電離平衡不產(chǎn)生影響的粒子是( )
A. 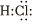
B.26Fe3+ C. 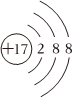
D. 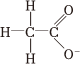 組卷:73引用:20難度:0.7
組卷:73引用:20難度:0.7 -
3.在相同溫度下,100mL 0.01mol?L-1醋酸溶液與10mL 0.1mol?L-1醋酸溶液相比較,下列數(shù)值中,前者大于后者的是( )
A.醏酸的電離常數(shù) B.H+的物質(zhì)的量 C.完全中和時所需NaOH的量 D.CH3COOH的物質(zhì)的量 組卷:145引用:53難度:0.7 -
4.下列說法正確的是( )
A.pH=2與pH=1的硝酸中c(H+)之比為1:10 B.Na2CO3溶液中c(Na+)與c(CO32-)之比為2:1 C.0.2 mol?L-1與0.1mol/L醋酸中c (H+)之比為2:1 D.NO2溶于水時,被氧化的n(NO2)與被還原的n(NO2)之比為3:1 組卷:18引用:9難度:0.7 -
5.0.1mol?L-1KHS溶液中(呈堿性),下列表達式不正確的是( )
A.c(K+)+c(H+)=c(OH-)+c(HS-)+2 c(S2-) B.c(K+)>c(HS-)>c(OH-)>c(S2-)>c(H+) C.c(HS-)+c(S2-)+c(H2S)=0.1 mol?L-1 D.c(K+)>c(HS-)>c(OH-)>c(H2S)>c(H+) 組卷:156引用:22難度:0.7 -
6.某酸性溶液中只有Na+、CH3COO-、H+、OH-四種離子。下列描述可能正確的是( )
A.該溶液由pH=3的CH3COOH與pH=11的NaOH溶液等體積混合而成 B.該溶液由等物質(zhì)的量濃度、等體積的NaOH溶液和CH3COOH溶液混合而成 C.加入適量的NaOH,溶液中離子濃度為c(CH3COO-)>c(Na+)>c(OH-)>c(H+) D.加入適量氨水后,c(CH3COO-)會大于c(Na+)、c(NH4+)之和 組卷:50引用:12難度:0.5 -
7.在25℃時將pH=11 的NaOH 溶液與pH=3 的CH3COOH溶液等體積混合后,下列關(guān)系式中正確的是( )
A.c (Na+)═c(CH3COO-)+c(CH3COOH) B.c(H+)═c(CH3COO-)+c(OH一) C.c (Na+)>c (CH3COO-)>c(OH-)>c(H+) D.c (CH3COO-)>c(Na+)>c(H+)>c(OH-) 組卷:102引用:17難度:0.7 -
8.已知CuSO4溶液分別與Na2CO3溶液、Na2S溶液的反應(yīng)情況如下:
(1)CuSO4+Na2CO3 主要:Cu2++CO32─+H2O═Cu(OH)2↓+CO2↑
次要:Cu2++CO32─═CuCO3↓
(2)CuSO4+Na2S 主要:Cu2++S2─═CuS↓
次要:Cu2++S2─+2H2O═Cu(OH)2↓+H2S↑
則下列幾種物質(zhì)的溶解度大小的比較中,正確的是( )A.CuS<Cu(OH)2<CuCO3 B.CuS>Cu(OH)2>CuCO3 C.Cu(OH)2>CuCO3>CuS D.Cu(OH)2<CuCO3<CuS 組卷:133引用:31難度:0.9
二、填空(本題包括5個小題,共46分)
-
24.甲同學(xué)懷疑調(diào)整至溶液pH=4是否能達到除去Fe3+而不損失Cu2+的目的,乙同學(xué)認為可以通過計算確定,他查閱有關(guān)資料得到如下數(shù)據(jù),常溫下Fe(OH)3的溶度積Ksp=8.0×10-38,Cu(OH)2的溶度積Ksp=3.0×10-20,通常認為殘留在溶液中的離子濃度小于1×10-5 mol?L-1時就認為沉淀完全,設(shè)溶液中CuSO4的濃度為3.0mol?L-1,則Cu(OH)2開始沉淀時溶液的pH為
,F(xiàn)e3+完全沉淀時溶液的pH為,通過計算確定上述方案(填“可行”或“不可行”);理由。組卷:207引用:8難度:0.1 -
25.pH=12的NaOH溶液100mL,要使它的pH為11.(體積變化忽略不計)
(1)如果加入蒸餾水,應(yīng)加mL;
(2)如果加入pH=10的NaOH溶液,應(yīng)加mL;
(3)如果加0.01mol/L HCl,應(yīng)加mL.組卷:194引用:22難度:0.3


