2022-2023學年廣東省廣州六中高一(下)開學化學試卷
發布:2024/12/7 2:30:1
一、單項選擇題(本題共18小題,1-10每題2分,11-18每題3分;共44分。)
-
1.2022年的北京冬奧會給人們奉獻了一場冰雪盛宴,在短道速滑的比賽中運動員所穿冰鞋的冰刀材料為鋁、鎂、鈦等的合金,下列有關合金說法錯誤的是( )
A.生鐵的含碳量高于鋼 B.合金的硬度比其成分金屬大 C.鈦合金耐高溫用于制造飛機發動機 D.不銹鋼中主要含鐵、鎘、銅三種金屬元素 組卷:57引用:4難度:0.8 -
2.下列物質的分類組合正確的是( )
①膽礬、氫氧化鐵膠體、豆漿均為混合物
②NaHSO4、AgCl、AlCl3、CaCO3均為鹽
③Mg(OH)2、NaOH、Cu2(OH)2CO3、NH3?H2O均為堿
④干冰、CO、H2O均為酸性氧化物
⑤金剛石、石墨、C60互為同素異形體A.②⑤ B.③⑤ C.①②③⑤ D.④⑤ 組卷:22引用:5難度:0.8 -
3.下列各組離子在給定條件的溶液中一定能大量共存的是( )
A.在強酸性溶液中:Fe2+、K+、Cl-、ClO- B.加入鋁粉有大量氫氣產生的溶液中:Na+、Ca2+、Br-、HCO3- C.在無色溶液中:Cu2+、NO3-、K+、Cl- D.滴入酚酞顯紅色的溶液中:K+、Na+、SO42-、CO32- 組卷:81引用:7難度:0.7 -
4.化學使生活更美好。下列生產生活情境中涉及的化學原理錯誤的是( )
選項 生產生活情境 化學原理 A 蒸饅頭時加入小蘇打,面團在發酵和蒸熟過程中體積均變大 NaHCO3與酸反應和加熱條件下均能產生CO2氣體 B 卡塔爾世界杯開幕式煙花秀流光溢彩 焰色試驗屬于化學變化 C 用FeCl3溶液刻蝕銅電路板 氧化性:Fe3+>Cu2+ D 工人將模具干燥后再注入熔融鋼水 鐵與H2O高溫下會反應 A.A B.B C.C D.D 組卷:29引用:2難度:0.6 -
5.價-類二維圖是一種重要的學習工具,氯的價-類二維圖如圖。下列說法錯誤的是( )
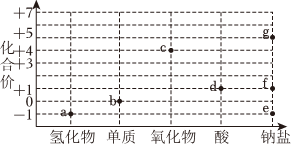
A.a→b需要加氧化劑 B.f→d可以加稀硫酸 C.b和燒堿反應可得e和f D.c不能用作自來水消毒劑 組卷:42引用:2難度:0.6 -
6.下列說法不正確的是( )
A.H2O分子結構式為:H-O-H B.HF的電子式: 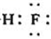
C.FCl3分子中各原子均達到8電子穩定結構 D.水汽化時破壞了范德華力和氫鍵 組卷:28引用:1難度:0.8 -
7.設NA為阿伏加德羅常數的值。下列有關敘述正確的是( )
A.常溫下,0.1molNaHSO4固體中含有的陽離子數為0.1NA B.0.5mol/LAlCl3溶液中的Cl-數目為1.5NA C.0.1molNa2O2與足量的水反應,轉移電子的數目為0.2NA D.標準狀況下,11.2LCCl4所含的分子數為0.5NA 組卷:25引用:2難度:0.6
二、非選擇題(共56分)
-
21.某小組通過實驗探究氧化還原反應的規律。
已知:氧化還原反應電位傳感器可以測量不同溶液的電位值,根據電位值大小可比較物質的氧化性/還原性強弱;數值越大,氧化性越強,數值越小,還原性越強。
測得幾種物質的電位值如表所示。(注:實驗中進行酸化時均用稀硫酸)
根據表中數據,回答下列問題:物質 H2O2 H2O2(酸化) FeCl3 KMnO4(酸化) NaNO3(酸化) NaBr KI Na2S 濃度 5% 5% 0.1mol?L-1 電位值/mV 276 683 671 1130 603 362 116 -361
(1)濃度均為0.1mol?L-1的下列三種溶液,氧化性由強到弱的順序為(填序號)。
①FeCl3
②酸性KMnO4
③酸性NaNO3
(2)影響物質氧化性強弱的因素有、。
(3)已知Fe3+與I-不能共存,由此推測下列一定不能大量共存的離子組是(填序號)。
a.Fe3+、Br-
b.Fe3+、S2-
c.NO3-、H+、I-
d.H+、MnO4-、I-
(4)向等濃度的NaBr和KI混合溶液滴加少量酸性KMnO4溶液,發生反應的離子方程式為。(已知MnO4-在酸性環境下的產物為Mn2+)
(5)往淀粉-KI溶液中逐滴加入氯水,觀察到溶液先變藍后褪色。小組同學就溶液褪色的原因,提出兩種猜想,并設計如下實驗進行驗證。請填寫下列空白。
猜想1:①。
猜想2:I2被氯水繼續氧化
查閱資料:HClO不能漂白淀粉與I2結合形成的藍色物質。
④寫出實驗3反應的離子方程式為序號 實驗操作 試劑 現象 結論 實驗1 分別取少量褪色的溶液于三支試管中,并加入對應試劑,觀察實驗現象 ② ③ 猜想1不正確 實驗2 淀粉溶液 溶液不變藍 猜想2正確(I2被氧化為IO3-) 實驗3 KI+稀H2SO4 溶液變藍 。組卷:22引用:1難度:0.6 -
22.隨著新能源汽車銷量的猛增,動力電池退役高峰將至,磷酸鐵鋰(LEP)是目前使用最多的動力電池材料,因此回收磷酸鐵鋰具有重要意義。一種從廢舊磷酸鐵鋰正極片(LiFePO4、導電石墨、鋁箔)中回收鋰的工藝流程如圖:

已知:i.廢舊磷酸鐵鋰正極片中的化學物質均不溶于水也不與水反應。
ii.Li2CO3在水中的溶解度隨溫度升高而降低,但煮沸時與水發生反應。
回答下列問題:
(1)LiFePO4中鐵元素的化合價為。
(2)向堿浸后的濾液中通入過量的CO2所發生反應的離子方程式為:。
(3)“氧化浸出”時,保持其他條件不變,不同氧化劑對鋰的浸出實驗結果如下表,實際生產中氧化劑選用H2O2,不選用NaClO3的原因是。在“氧化浸出”時,適當的升溫可加快反應速率,但一般不采取高溫法,其原因是。“氧化浸出”時生成了難溶的FePO4,該反應的化學方程式為。
(4)“浸出液”循環兩次的目的是序號 鋰含量/% 氧化劑 pH 浸出液Li+濃度/(g?L-1) 浸出渣中Li+含量/% 1 3.7 H2O2 3.5 9.02 0.10 2 3.7 NaClO3 3.5 9.05 0.08 3 3.7 O2 3.5 7.05 0.93 4 3.7 NaClO 3.5 8.24 0.43 。
(5)“濾渣Ⅱ”經純化可得PO4,流程中生成的Li2CO3、FePO4在高溫條件下與H2C2O4煅燒可得LiFePO4(已知H2C2O4有還原性),實現再生利用,其化學方程式為+3Fe。
(6)“一系列操作”具體包括水浴加熱、、洗滌、干燥。組卷:11引用:2難度:0.7


